공부를 하다 보면, 특정 개념을 보고, 그 개념의 어감이 주는 무시무시함에 지레 겁먹고 포기해 버릴 때가 간혹 있다.
수학에서의 미적분(Calculus)이 그랬고, 화학에서는 오비탈(Orbital), 특히 오비탈의 혼성화(Hidridization)가 그랬다.
고등학교 화학에서는 오비탈의 혼성화에 대해 제대로 다루지 않았어서 내 걱정은 그저 기우(杞憂)였지만, 오비탈에 대한 막연히 두려워했던 기억은 아직도 생생히 남아있다.
이 글에서는 오비탈의 혼성화(Hidridization)에 대해, 탄소 간 결합에 중점을 두어 다룰 것이다. 그 내용을 설명하기에 앞서, 혼성 오비탈 모형 자체에 대해 잠깐 짚고 넘어가도록 하자.
원자 정도의 스케일에서, 원자들의 상호작용은 양자역학적 거동을 따른다.
즉, 오비탈을 포함해 이들을 설명하는 모든 이론은 양자역학(Quantum mechanics)에 근간을 둔다.
양자역학은 물리학이기 때문에, 수학, 그것도 굉장히 복잡한 수학에 근간을 둔다. 원자의 거동을 이해하기 위해 양자역학을 공부하고, 이를 위해 다시 수학을 공부하고... 뭔가 주객전도가 된 것 같다.
그래서 과학자들은 복잡한 양자역학적 계산을 보다 직관적으로 이해하기 위해 모델(Model)을 사용한다.
실제 계산 결과가 어찌되었든, 일어나는 현상을 설명하기 위해 가정을 하고, 그림을 그리는 것이다.
혼성 오비탈(Hybrid orbital) 모형 또한 양자역학적 근거가 없는 '모델'에 불과하다는 사실을 기억하자.
그저 복잡한 원자 사이의 결합을 직관적으로 이해하기 위한 도구 중 하나일 뿐이다.
혼성 오비탈이 왜 이렇게 형성되어야 하는지, 어떤 이유 때문에 오비탈이 혼성되는지 알 필요가 없다는 뜻이다. 그냥 현상을 설명하고 이해시키기 위한 모델일 뿐이니까.
이 글에서 탄소 및 간단한 화합물들의 오비탈 혼성에 대해 상세히 설명할 것이고, 결국 그 과정을 이해해야겠지만, 중요한 것은 모형으로 인해 나타나는 '결과'라는 것이다.
1. CH4의 경우
이전 글에서, 오비탈로 표현한 탄소의 전자 배치에 대해 다뤘었다. 탄소의 경우 2s 오비탈까지 가득 차있고, 2p 오비탈에 2개의 전자가 들어있다.

고전적인 원자가 결합 이론(VBT)에서, 원자의 결합은 가장 바깥의 오비탈끼리 겹쳐지며 결합을 형성한다.
H는 1s 오비탈에 1개의 전자가 채워져 있으므로, 각 수소 원자의 1s 오비탈이 겹쳐지며 수소 분자를 형성하는 것이다.
이렇게 단순하게 생각할 경우, 탄소와 수소의 결합은 이상한 점이 있다.
탄소의 가장 바깥 오비탈은 2p 오비탈이고, 2개의 전자가 채워져 있다.
원자가 결합 이론에 따르면, 탄소와 수소의 결합은 2p 오비탈과 2s 오비탈의 결합이 되어야 하며, 결과적으로 CH2가 만들어져야 한다. 탄소의 2s 오비탈은 이미 안정하니까, 결합에 참여할 이유가 없는 것이다.
하지만 실제로 탄소와 수소의 결합은 CH4를 형성한다. 4개의 결합이 이뤄지는 것이다. 이를 설명하기 위해 혼성 오비탈 모형이 도입되었다.

혼성 오비탈 모형에서, 탄소 원자는 결합할 때 전자의 배치를 바꾼다. 우선 s 오비탈에서 p 오비탈로 전자 하나를 건네준 후, s오비탈의 방 1개, p 오비탈의 방 3개를 섞어, 안정성이 똑같은 방 4개를 만든다. 즉, 4개의 똑같은 오비탈을 만든다.
이를 새로운 sp3 오비탈이라 표기하며, 오비탈의 혼성화(Hidridization)가 일어났다고 표현한다. (이 경우 sp3 혼성화라 부른다.)

탄소의 4개의 sp3 오비탈이 수소의 s 오비탈들과 결합하여 위 그림처럼 메테인을 형성하게 된다.
여기서 중요한 것은, 오비탈 혼성화가 일어났기 때문에 탄소와 수소가 메테인을 형성하는 것이 아니라, 탄소와 수소의 결합은 메테인을 형성하기 때문에 혼성 오비탈 모형을 도입했다는 것이다.
원인과 결과를 혼동하지 말 것. 혼성 오비탈은 (옥텟규칙, 전자 궤도와 같은) 그저 모형이라는 것을 기억하자.
2. C2H6(에테인, Ethane)의 경우

에테인의 경우도 sp3 혼성화로 설명할 수 있다. 탄소-탄소 결합이 sp3-sp3 결합이 되는 것이다. 수소-탄소 결합은 sp3-s 결합이다.
3. C2H4(에텐, Ethene)의 경우
에텐은 에테인에서 탄소-탄소 결합이 이중결합으로 바뀐 화합물이다.
앞서 sp3 혼성화에서, 에테인은 탄소-수소 결합 사이의 결합각이 109.5°이고, 정사면체 모양을 이뤘다.
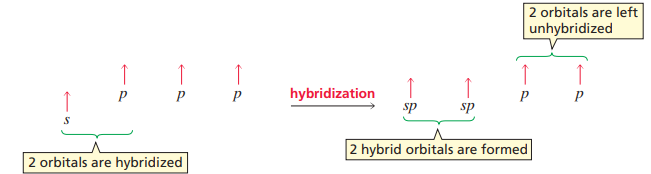
하지만 에텐은 결합각이 120°에 가까운 정삼각형 모양을 이룬다. 이를 설명하기 위해 sp2 혼성화가 도입되었다.

sp2 혼성화는 p 오비탈 중 2개만 s 오비탈과 혼성화를 이루고, 1개의 p 오비탈은 남게 된다. 이때 3개의 sp2 오비탈은 p 오비탈보다 안정하다.

3개의 sp2 오비탈 중 2개는 수소의 s 오비탈과 sp2-s 결합을 이루고, 1개는 다른 탄소와 sp2-sp2 결합을 이룬다. 그럼 남은 p 오비탈은?
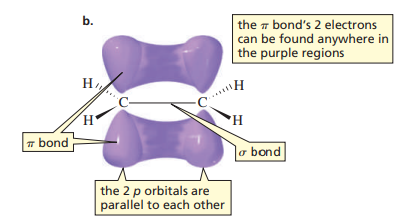
탄소-탄소 간 p-p 결합을 이루게 된다. p 오비탈은 8 자 모양이므로, 두 부분에서 결합이 이루어지는데(그렇다고 해서 이중 결합이라는 것은 아니다. 전자구름이 두 군데에서 겹친다는 의미로 받아들여야 한다.) 이를 π 결합(pi bond)이라 한다.
sp2-sp2 결합처럼 이와 대비되는 일직선 결합은 σ 결합(sigma bond)이라 부른다.
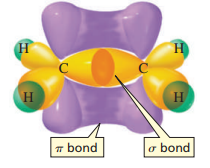
결과적으로 에텐의 결합 모형은 위 그림과 같다. 탄소-탄소 이중 결합은 하나의 σ 결합과 하나의 π 결합으로 구성되는 것이다.
그림만 봐도 π 결합이 포함되니 답답해 보이지 않는가?
π 결합으로 인해 이중 결합은 회전이 불가능해지고, 이는 탄소-탄소의 단일 결합과 이중 결합의 가장 중요한 차이점 중 하나가 되니 꼭 기억해두자.
3. C2H2(에타인, Ethyne)의 경우
에타인은 탄소-탄소의 삼중 결합을 포함하는 화합물이다. 결합의 추이가 어떻게 될지 예상해 보자.
에타인은 p 오비탈 하나만이 s 오비탈과 혼성화해 2개의 sp 오비탈을 만들고, 2개의 p 오비탈을 남겨둔다.
그 후, 에텐에서처럼 2개의 sp 오비탈 중 1개는 탄소-수소 결합에, 나머지 1개는 탄소-탄소 결합에 사용한다.
남은 p 오비탈은?
에텐에서처럼 탄소-탄소의 π 결합을 이룬다. 이 경우 p 오비탈이 2개이므로, π 결합도 2개가 된다.
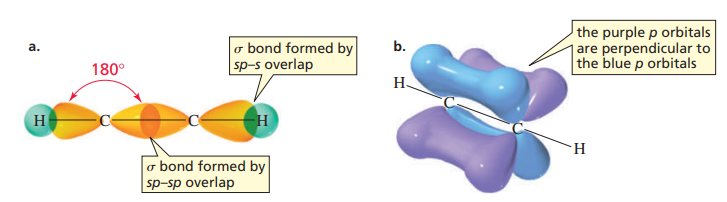
화합물에서 어떤 결합이 σ 결합이고 π 결합이 되는지 아는 것은 매우 중요하다. 화합물에서 몇 개의 혼성 오비탈이 형성될 것인지, σ, π 결합이 몇 개씩 생길지 정확히 알 수 있어야 한다. 어떤 원자끼리의 결합이든 σ 결합은 1개밖에 만들어질 수 없다는 걸 유념하자.
4. +CH3, ㆍCH3, -CH3의 경우
각각 메틸 양이온(Methyl cation), 메틸 라디칼(Methyl radical), 메틸 음이온(Methyl anion)이다.
메틸 양이온과 메틸 라디칼은 sp2 혼성, 메틸 음이온은 sp3 혼성이 일어난다.
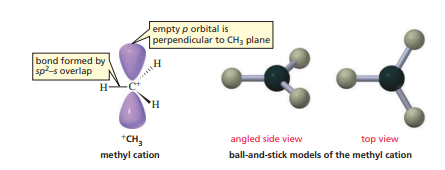
탄소가 3개의 수소와 결합을 이뤄야 하므로 3개의 sp2 오비탈을 만들고, 남은 p 오비탈은 어차피 전자가 없으니 내버려 두었다 생각해도 된다.
평면 삼각형의 분자 구조를 이루며, 남아있는 홀전자가 없으므로 굉장히 안정적이다. 메틸이온은 일반적으로 메틸 양이온의 상태로 자연계에 존재한다.
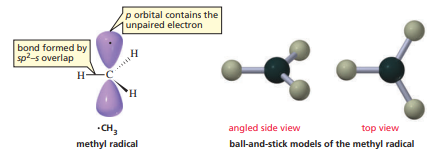
메틸 라디칼은 메틸 양이온에서 전자 하나가 추가된 것이다. 추가된 전자는 남아있는 p 오비탈에 채워진다. 메틸 라디칼은 자연계에서 오래 존재할 수 없고, 보통 서로 결합해 에테인을 형성하곤 한다.
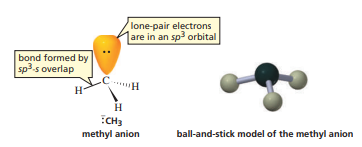
반면, 메틸 음이온은 자기 혼자 sp3 혼성화를 해 삼각뿔 모양의 분자 구조를 갖는다.
비공유 전자쌍이 위에 덩그러니 혼자 있는 걸 보면 암모니아의 분자 구조와도 흡사하다. 매우 불안정한 화합물이므로, 자연 상태에서는 거의 존재하지 않는다.
5. 암모니아(NH3), 물(H2O)의 경우
두 분자 모두 sp3 혼성화를 한다. 설명은 에테인의 경우와 같으니, 그림으로 보고 이해하자.

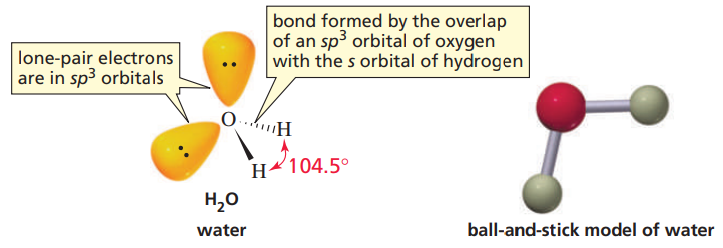
이 외에도, 혼성 오비탈 모형에 대해 더 많은 내용이 있지만, 유기화학을 배우는 데 필요한 부분은 이 정도이다.
가장 중요하게 기억해야 할 것은 σ, π 결합의 구분과, π 결합은 회전이 되지 않는다는 것이다.
이는 다양한 탄소 화합물의 화학, 물리적 성질을 결정하는 데 중요한 역할을 한다.
다음 글에서는 화학의 기초 내용 중 하나인 산, 염기에 대해 간단히 다뤄볼 것이다.
'유기화학' 카테고리의 다른 글
| [유기화학] 알케인의 명명 (Nomenclature of Alkane) - 2 (0) | 2023.10.10 |
|---|---|
| [유기화학] 알케인의 명명 (Nomenclature of Alkane) - 1 (1) | 2023.09.29 |
| [유기화학] 산과 염기 (Acids and Bases) (0) | 2023.09.19 |
| [유기화학] 전자 구조와 결합 (Electronic Structure and Bonding) - 1 (0) | 2023.09.02 |