생화학에 이어 블로그에 쓰게 될 두 번째 과목은 유기화학이다.
포스팅의 전체적인 흐름과 자료는 Paula Yurkanis Bruice의 Essential Organic Chemistry 3rd edition을 따르되, 중간중간 이해를 돕기 위한 나의 사견, 첨언이 들어갈 것이다.
생화학 때보다 조금 쉽게 써보고자 노력해 보겠지만, 성공할지는 잘 모르겠다.
각설하고, 바로 본론으로 들어가보자.
유기화학(Organic chemistry)이란 무엇인가?
18세기 초, 화학자들은 생물과 무생물을 구성하는 물질이 각각 다르다고 믿었고, 생물을 구성하는 화합물을 유기 화합물(Ogarnic compounds)이라 불렀다.

그러던 1828년, 프리드리히 뵐러(Friedrich Wöhler)가 일반적으로 시안화암묘늄에서 유기 화합물인 요소(Urea)를 합성해 냈고, 무기 화합물과 유기 화합물은 본질적으로 다르지 않다는 것을 밝혀냈다.
때문에 유기 화합물에 대한 새로운 정의가 필요해졌고, 현재 유기화학의 일반적인 정의는 '탄소를 포함하는 화합물'에 대한 화학이다.
탄소(Carbon)는 4개의 원자가 전자를 가져 정말 수많은 결합이 가능한 원소이다.
탄소로 만들어낼 수 있는 다양한 유기 화합물에 대해 이야기하기 전에, 이 글을 포함한 2~3개 글에 걸쳐서 유기화학을 공부하는 데 필요한 기본적인 화학 지식에 대해 다루고 넘어갈 것이다.
1. 원자의 구조
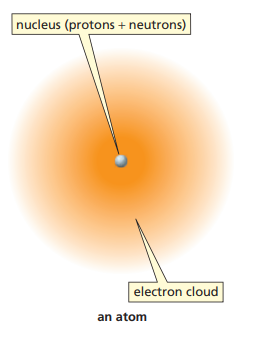
원자의 구조는 간단하게 다루고 넘어가자.
원자는 중심부에 핵(Nucleus)이 존재하고, 그 주위를 전자(Electron)가 둘러싸고 있다.
관습적으로 전자는 원자핵 주위의 특정 궤도를 돌고 있다고 표현하지만, 전자의 실제 모습은 위 그림과 같이 전자구름(Electron cloud)의 모습과 더 가깝다.
원자핵은 다시 양성자(Proton)와 중성자(Neutron)로 구성된다. 양성자는 양전하를 갖고, 중성자는 전하를 갖지 않는다. 즉, 원자핵은 양전하를 갖는다.
전자는 음전하를 갖는다. 일반적으로 자연 상태의 원소는 같은 수의 양성자와 전자를 가지므로, 원자의 전하는 0이다.

원자의 이름은 원자 번호(Atomic number)를 따른다. 원자 번호는 그 원자의 양성자 수와 같다. 즉, 양성자 수가 6개(전자 수가 6개)인 원자는 모두 원자 번호 6번, 탄소라고 부른다.
다만, 양성자 수가 같아도 중성자 수가 다를 수 있다. 한 원자에서 '양성자 수 + 중성자 수'를 질량수(Mass number)라 하고, 원자 번호는 같지만 질량수가 다른 원소들을 동위원소(Isotope)라 부른다.
같은 원소의 동위원소들은 거의 같은 화학적 성질을 갖지만, 물리적 성질 및 반감기(Half lives)가 매우 다르다. 탄소의 경우 12C가 가장 안정한 동위원소이다.
원소의 종류는 원자 번호, 즉 원자의 양성자 수(전자 수)에만 의존한다는 점을 꼭 기억해 두자.
2. 오비탈
아까 원자핵 주위의 전자가 전자구름의 형태로 존재한다는 것을 떠올려보자. 구름이라고 해서, 모든 영역에 전자가 존재할 확률이 같은 것은 아니다.
실제로는 조금 더 복잡하지만, 전자의 에너지 상태에 따라 전자가 존재할 확률이 높은 곳이 있고, 이를 오비탈(Orbital, 궤도함수)이라 부른다.
오비탈의 크기가 커질수록, 전자가 존재할 확률이 높은 곳이 많아지므로, 더 많은 전자가 들어갈 수 있다고 생각하자.

이 오비탈들은 핵 주위의 전자껍질(Shell)에 맞춰서 분포한다. 핵으로부터 멀리 떨어진 전자껍질일수록, 더 많은 오비탈이 들어갈 수 있다.
오비탈에는 s, p, d, f 오비탈이 있다. 각 오비탈은 1, 3, 5, 7개의 전자 방을 가지며(비유적 표현이다), 각 방에는 2개의 전자(위, 아래 스핀을 갖는)가 들어갈 수 있다.
예를 들어, d 오비탈은 5개의 전자 방이 있으므로, 각 방에 2개씩 총 10개의 전자가 들어갈 수 있다.
첫 번째 전자껍질(First shell, n = 1이라 주로 표현한다.)에는 오직 s 오비탈만이 들어갈 수 있다. 두 번째 전자껍질은 s, p 오비탈이, 세 번째 전자껍질에는 s, p, d 오비탈이 들어간다.
s 오비탈은 세 전자 껍질에 모두 들어갈 수 있으므로, 각각을 1s, 2s, 3s로 표기하여 구분한다.
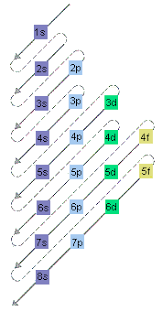
전자는 항상 본인이 안정된 상태에 있기를 원한다.
때문에, 더 안정적인 오비탈에 먼저 들어가길 원하고, 오비탈의 안정도는 대체적으로 위 그림의 순서를 따른다. 즉, 1s 오비탈이 가장 안정적이다.
또한, 3d 오비탈보다 4s 오비탈이 더 안정하므로, 전자는 우선 4s 오비탈을 채운 후 다시 세 번째 전자껍질의 d 오비탈을 채우기 시작한다.
오비탈에 대한 심화적인 내용은 필요할 때 다시 다루도록 하자.
우리는 이제부터 탄소 화합물을 중점적으로 다룰 것이기 때문에, 탄소가 갖는 2p까지의 오비탈에 대해 조금 더 알아보도록 하자.

p 오비탈은 앞서 3개의 전자 방을 갖는다 표현했는데, 이를 각각 px, py, pz라 표기한다. 왜 이렇게 표기하는지는 이 글에 쓰기엔 너무 방대한 내용이기 때문에, 우선은 어떻게 표기하는지만 기억하자.
원자번호 6번의 탄소는 6개의 전자를 갖는다. 탄소의 전자는 어떤 오비탈에 채워져 있는가?
우선, 2개의 전자는 가장 안정적인 1s 오비탈에 채워진다. 그다음 2개의 전자는 다음으로 안정적인 2s 오비탈에 채워진다.
그럼 남은 2개의 전자는?
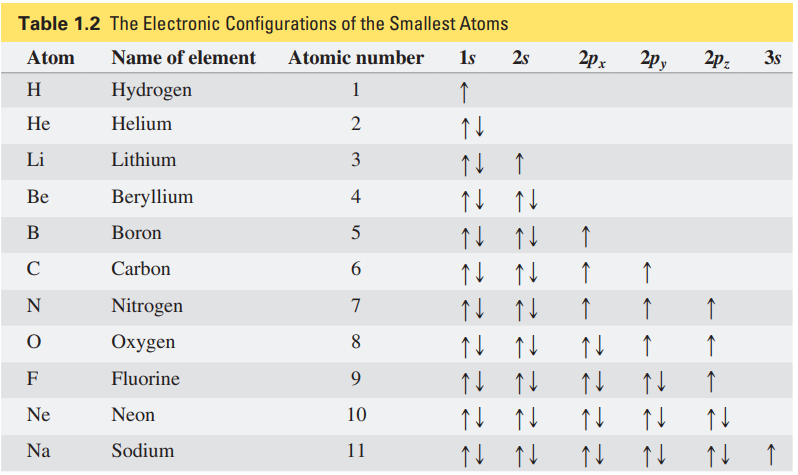
2p 오비탈의 각 방에 1개씩 들어가게 된다. 이는 한 방에 2개의 전자가 들어가는 것은 불안정하기 때문이다.
또한, 탄소의 전자 배치를 오비탈을 이용해 1s22s22p2라 표기할 수 있다.
위 내용은 유기화학을 이해하는 데 필요한 만큼 원자 구조 및 오비탈에 대한 내용을 각색한 것이다. 다음 글에서는 탄소의 전자 배치를 바탕으로, 공유결합 시 오비탈이 어떻게 변화하는지, 즉 오비탈의 혼성화(Hydridization)에 대해 알아볼 것이다.
'유기화학' 카테고리의 다른 글
| [유기화학] 알케인의 명명 (Nomenclature of Alkane) - 2 (0) | 2023.10.10 |
|---|---|
| [유기화학] 알케인의 명명 (Nomenclature of Alkane) - 1 (1) | 2023.09.29 |
| [유기화학] 산과 염기 (Acids and Bases) (0) | 2023.09.19 |
| [유기화학] 전자 구조와 결합 (Electronic Structure and Bonding) - 2 (0) | 2023.09.02 |