넘치는 포도당은 식물에서 전분, 녹말의 형태로, 동물에서 글리코겐(Glycogen)이라 불리는 중합체의 형태로 저장된다. 특히 척추동물에서 글리코겐은 간 무게의 약 10%를 차지할 정도로 중요하다. 포도당을 글리코겐으로 저장하는 이유는 포도당이 혈액에 떠다님으로써 혈당을 높이는 것을 막기 위함이다.
글리코겐 기본 입자는 약 55,000개의 포도당 분자로 구성되며, 12~14개 정도의 포도당이 가지를 이루고, 각각의 가지가 분지점에서 서로 얽혀있는 구조이다. 글리코겐의 노출된 가지 끝부분은 포도당의 4번 탄소(비환원 말단) 방향이다. 글리코겐 과립(Granules)은 글리코겐 분자와 글리코겐 합성, 분해 효소, 효소 조절 인자 등으로 구성된 복잡한 집합체다.

글리코겐은 주로 간과 근육에서 저장되는데, 두 기관의 글리코겐 이용 목적은 어느 정도 차이가 있다. 근육에서의 글리코겐은 에너지 생산을 위해 분해된다. 즉, 근육 글리코겐은 갑작스러운 운동 등을 대비해 일종의 에너지 저장고 역할을 하는 셈이다. 반면, 간의 글리코겐은 혈당 하락에 대비하는 것을 목적으로 한다. 혈당이 줄어들면 간은 글리코겐을 분해해 생긴 포도당을 혈중으로 방출한다. 이는 뇌처럼 오직 포도당만을 에너지원으로 사용할 수 있는 기관에 있어 매우 중요하다.
이번 글에서는 글리코겐 대사의 기본적인 내용과, 글리코겐 대사가 어떻게 조절되는지에 대해 알아보도록 하자.

1. 글리코겐 대사
1) 글리코겐 분해
글리코겐 분해는 글리코겐 가인산분해효소(Glycogen phosphorylase, 줄여서 가인산분해효소로 표현하기도 함)에 의해 일어난다. 가인산분해효소는 글리코겐 가지의 끝, 비환원 말단에서부터 분지점에서 포도당 4 분자가 떨어진 지점에 이르기까지 포도당 간 결합을 가수분해한다.
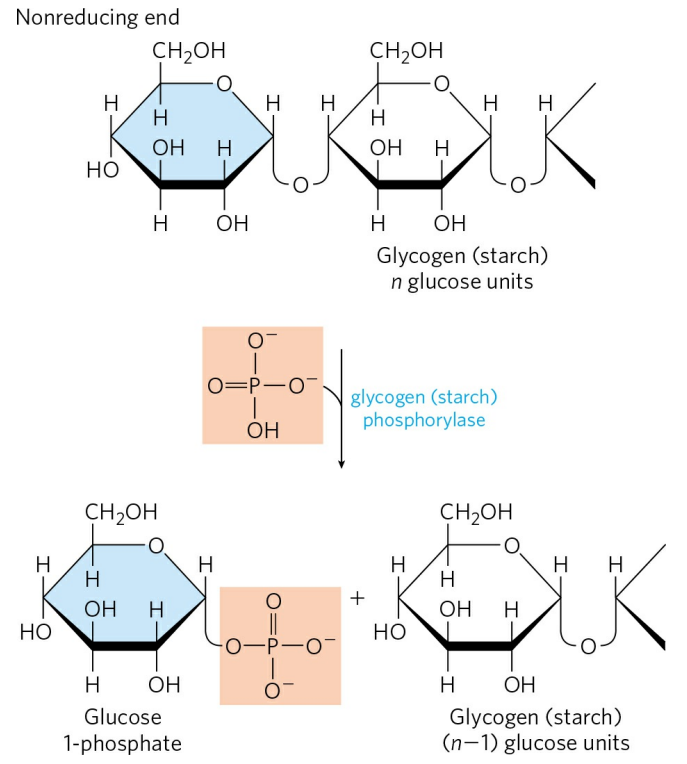
식이성 다당(녹말 등)은 소장에서 가수분해를 거쳐 단당인 포도당으로 분리된다. 반면 간 또는 근육에서 글리코겐은 가인산분해를 거쳐 1-인산 포도당으로 분리된다. 당분해 첫 단계에서 포도당이 6-인산 포도당으로 ATP를 소모해 인산화되었던 것을 기억하는가? 글리코겐의 가인산분해는 당분해의 첫 단계를 대체해 1분자의 ATP를 절약하게끔 한다.
가인산분해가 멈추는 지점은 분지점에서 포도당 4분자가 떨어진 지점이다. 그 지점까지 가인산분해를 하고 나면, 이후 글리코겐 가지제거 효소(Glycogen debranching enzyme)가 일련의 과정을 통해 포도당 4분자짜리 가지를 제거한다.

글리코겐 가지제거효소는 두 가지 활성 부위를 갖는다. 우선, 포도당 4분자 중 3분자를 다른 가지로 옮긴다. 이는 전달효소 활성부위가 촉매한다. 이후 남은 1분자의 포도당이 떨어진다. 이는 글루코시데이스 활성부위가 촉매한다. 3분자가 옮겨진 긴 가지는 다시 가인산분해효소에 의해 1-인산 포도당으로 분리된다.
글리코겐으로부터 분리된 1-인산 포도당은 간과 근육에서 다른 운명을 갖는다.

근육에서 1-인산 포도당은 인산 포도당 변위효소(Phosphoglucomutase)에 의해 6-인산 포도당으로 전환된다. 6-인산 포도당은 그대로 당분해를 거쳐 에너지를 생산한다.
간에서 1-인산 포도당은 포도당 6-인산염분해효소(Glucose 6-phosphatase)에 의해 인산기가 떨어져 포도당으로 전환된다. 전환된 포도당은 혈액으로 이동해 혈당을 증가시킨다. 포도당 6-인산염분해효소는 간세포 소포체 내부에 갇혀 세포질과 분리되어 있는데, 이는 세포질에서 일어나는 당분해 과정을 방해하지 않기 위함이다. 이는 앞서 배웠던 조절기전 중 '효소의 구분'의 한 예시다.
2) 글리코겐 합성
글리코겐은 포도당의 중합체다. 글리코겐 형성에서 포도당의 공여체는 UDP-포도당(UDP-glucose)이다.

UDP-포도당은 1-인산 포도당과 삼인산 유리딘(UTP)이 반응해 형성된다. 1-인산 포도당은 대개 6-인산 포도당에서 전환되어 만들어진다. 1-인산 포도당과 삼인산 유리딘의 반응은 UDP-포도당 파이로포스포릴레이스(UDP-Glucose pyrophosphorylase)가 촉매한다. 반응식은 다음과 같다.
$ 1$-인산 포도당$ + UTP \rightarrow UDP$-포도당$ + PP_i $
UDP는 이 포도당이 글리코겐의 중합에 사용됨을 표지한다. 포도당의 분해는 에너지 대사에서 매우 중요하므로, UDP를 통한 표지(Tagging)는 글리코겐 합성에 이용되는 포도당을 당분해로부터 분리시키는 효과적인 전략이다.
표지된 UDP-포도당은 글리코겐 생성효소(Glycogen synthase)에 의해 글리코겐으로 합성된다.
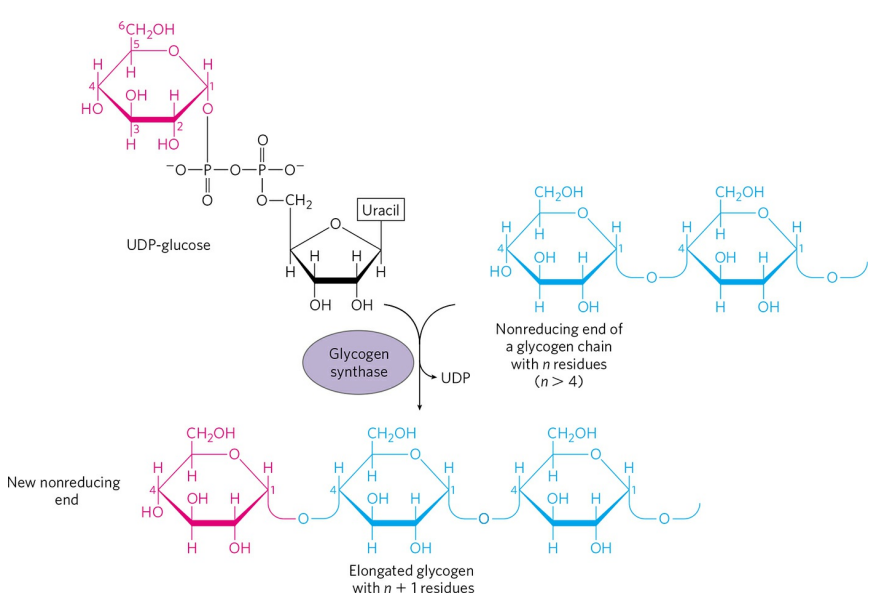
단, 글리코겐 생성효소는 한 분자의 포도당에서부터 글리코겐 합성을 시작할 수 없고, 특정한 시발체(Primer)를 필요로 한다. 본 글 첫 번째 그림에서 'G'로 표시된 부분, 단백질 글리코제닌(Glycogenin)이 글리코겐 합성의 시작점이다.
글리코제닌은 스스로 글리코겐 합성의 시발체면서, 두 가지 효소 활성을 갖는 효소이기도 하다. 일단 글리코제닌 단백질의 글루코실 전달효소(Glucosyltransferase) 활성자리가 최초의 포도당이 글리코제닌에 결합하도록 한다. 이후, 글리코제닌 단백질의 연장 효소 활성자리가 최대 7개의 UDP-포도당을 최초 포도당과 결합시켜 짧은 글리코겐 사슬을 만든다. 그러고나면 이 작업을 글리코겐 생성효소가 이어받아 글리코겐을 마저 연장한다.
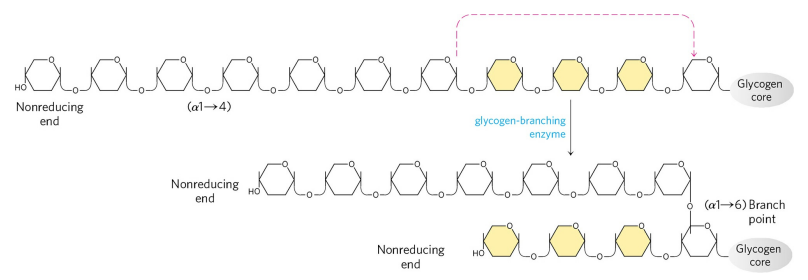
사슬이 충분히 길어지고 나면, 글리코겐 가지만들기 효소(Glycogen-branching enzyme)가 글리코겐 가지를 형성한다. 가지를 형성하는 이유는 글리코겐의 분해를 여러 말단에서 동시다발적으로 일어나게 하기 위함이다. 글리코겐이 사용되는 저에너지, 저혈당 상태는 최대한 빠른 해결을 요하므로, 글리코겐의 분해는 매우 신속하게 일어날 필요가 있기 때문이다.
2. 글리코겐 합성과 분해의 조절
글리코겐 분해와 합성의 조절은 아래의 세 가지 호르몬과 두 효소가 관여한다.
| 인슐린 | 글루카곤 | 에피네프린 | |
| 표적 기관 | 간 | 간 | 간과 근육 |
| 혈당 조절 | 감소 | 증가 | 증가 |
| 글리코겐 | 합성 촉진 | 분해 촉진 | 분해 촉진 |
| 글리코겐 가인산분해효소 | 글리코겐 생성효소 | |
| 활성형 / 불활성형 | a / b | a / b |
| 인산화될 때 | 활성화 | 불활성화 |
| 주요 조절인자 | PKA, PP1 등 | CKⅡ, GSK3 등 |
1) 글루카곤의 작용
글루카곤은 간에서 글리코겐의 분해를 촉진한다. 글리코겐의 분해는 글리코겐 가인산분해효소에 의해 일어난다. 가인산분해효소는 a와 b, 두 형태로 상호 전환이 가능하다. a형이 글리코겐을 분해할 수 있는 활성형이다. 글루카곤은 일련의 반응을 통해 가인산분해효소 b를 a로 활성화시킨다.
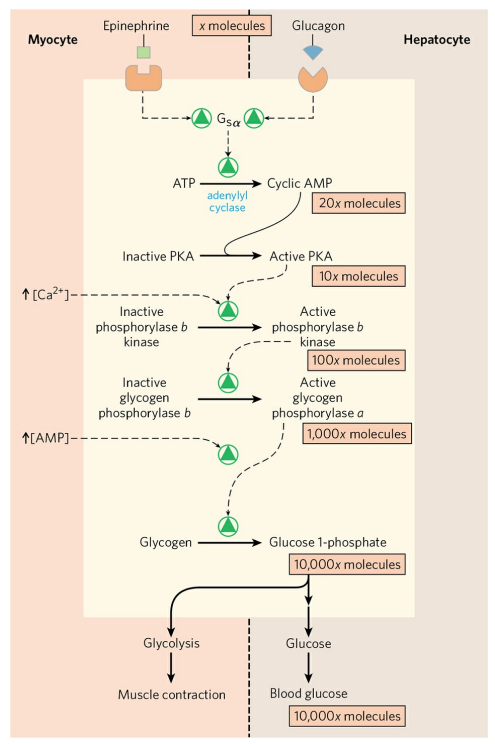
글루카곤은 우선 간세포의 글루카곤 수용체에 결합한다. 글루카곤 수용체는 GTP-결합 단백질(Gsα)을 활성화시킨다. Gsα는 cAMP 농도를 증가시키고, cAMP는 단백질 인산화효소 A(PKA)를 활성화시킨다. PKA는 다시 가인산분해효소 b 인산화효소를 활성화하고, 활성화된 가인산분해효소 b 인산화효소는 가인산분해효소 b를 인산화시켜 가인산분해효소 a 형태로 전환한다. 활성화된 가인산분해효소는 글리코겐 분해를 시작한다. 분리된 포도당은 혈당을 증가시킨다.
위와 같이 여러 반응이 연쇄적으로 일어나는 반응을 효소 연쇄증폭(Enzyme cascade) 반응이라 한다. 이는 작은 초기 신호를 큰 신호로 변환하는데 필수적이다.
글루카곤의 작용으로 혈중 포도당 농도가 높아지면, 포도당은 다시 간세포로 돌아가 가인산분해효소 a와 결합해 효소의 인산화 기질을 노출시킨다. 노출된 인산화 기질은 가인산분해효소 a 인산염분해효소(PP1)에 의해 탈인산화되고, 가인산분해효소는 비활성형으로 돌아간다.
2) 인슐린의 작용
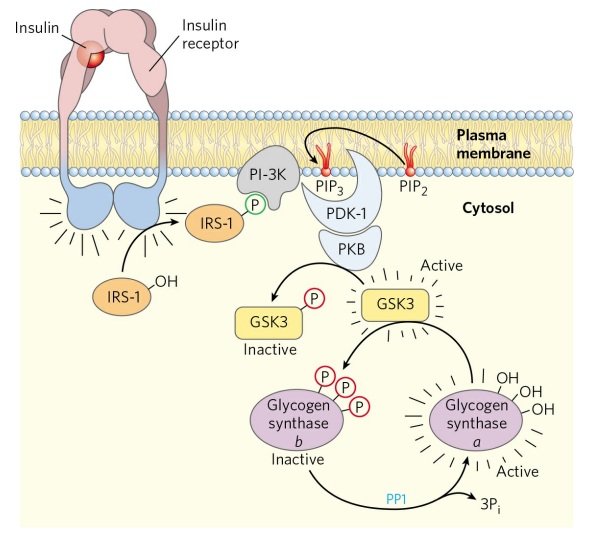
인슐린은 간에서 글리코겐의 합성을 촉진한다. 글리코겐의 합성은 글리코겐 생성효소에 의해 일어난다. 글리코겐 생성효소 또한 a와 b, 두 형태로 상호 전환이 가능하다. 마찬가지로 a형이 글리코겐을 합성할 수 있는 활성형이지만, 활성형에서 생성효소는 탈인산화되어있다.
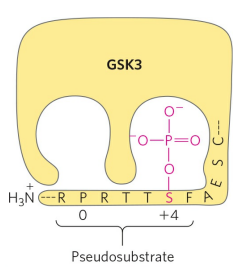
가인산분해효소와 다르게, 글리코겐 생성효소는 여러 잔기가 인산화되어야 불활성화된다. 이를 조절하는 것이 글리코겐 생성효소 인산화효소 3(GSK3)이다. GSK3는 평소 효소의 일부분인 가짜기질(Pseudosubstrate)에 인산화된 채 불활성화되어 있다. GSK3 가짜기질 인산화가 PP1에 의해 탈인산화되면, GSK3의 활성부위는 글리코겐 생성효소와 결합할 수 있다.
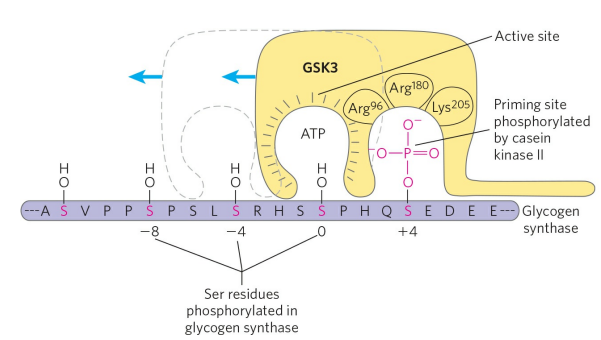
GSK3의 결합을 위해 우선 카세인 인산화효소(CKⅡ)가 글리코겐 생성효소 +4 위치를 인산화해야 한다. 그러고 나면, GSK3가 글리코겐 생성효소에 결합해 0, -4, -8 자리를 차례로 인산화하고, 글리코겐 생성효소는 불활성화된다.
인슐린은 GSK3를 이용해 글리코겐 생성효소를 조절한다. 인슐린이 간세포막의 인슐린 수용체에 결합하면, 인슐린 수용체는 일련의 과정을 통해 단백질 인산화효소 B(PKB)를 활성화한다. PKB는 GSK3의 가짜기질을 인산화시키고, GSK3가 결합하지 않은 글리코겐 생성효소는 PP1에 의해 탈인산화된다. 활성화된 글리코겐 생성효소 a는 글리코겐 합성을 시작한다.
3) 에피네프린의 작용
에피네프린은 근육에서 글리코겐의 분해를 촉진한다. 다만, 근육과 간의 가인산분해효소는 서로 다른 조절을 받는다. 이는 근육과 간에서 글리코겐 분해의 목적이 다르기 때문이다. 간에서 글리코겐의 분해는 혈당을 올리기 위해, 근육에서 글리코겐의 분해는 에너지의 공급을 위해 일어난다는 점을 기억하자.
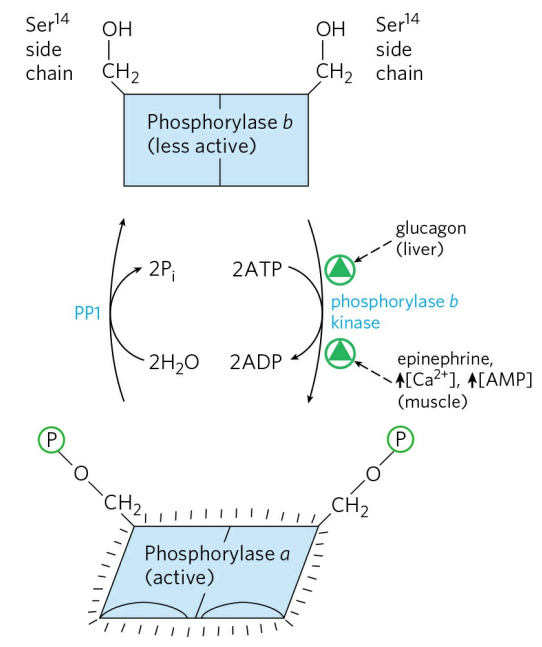
근육에서는 글리코겐 수용체 대신, 에피네프린 수용체가 GTP-결합 단백질을 활성화한다. 그 후 일련의 연쇄증폭 반응을 통해 글리코겐 가인산분해효소를 활성화한다.
추가로, 근육 글리코겐 가인산분해효소는 근육 수축을 위한 세포 내 신호인 칼슘 이온에 의해 활성화된다. 이는 근 수축시 사용되는 많은 에너지를 공급하기 위함이다. 많은 에너지를 소비하면 높아지는 [AMP]도 근육에서 가인산분해효소 활성을 높인다. 반면, 에너지가 충분할 경우 ATP는 AMP의 가인산분해효소 활성 높임을 저해한다.
에피네프린은 또한 근육의 당분해를 활성화해 글리코겐 분해의 산물인 포도당이 바로 에너지로 전환되도록 한다.
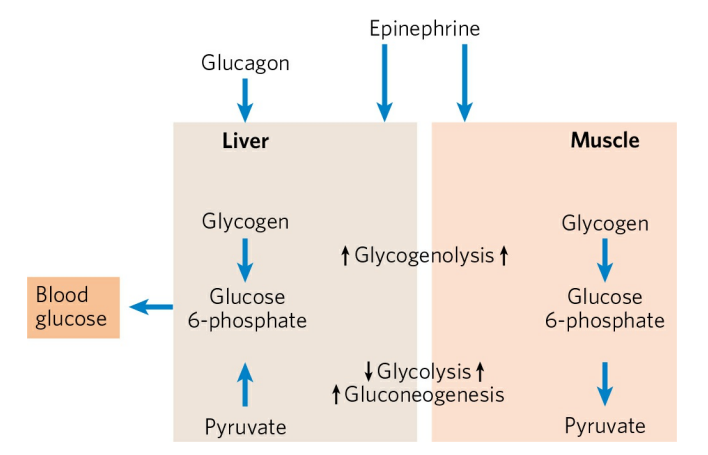
정리하자. 글리코겐 대사는 글루카곤, 인슐린, 에피네프린의 세 가지 호르몬이 조절한다. 각각의 호르몬은 글리코겐 가인산분해효소와 글리코겐 생성효소를 인산화, 탈인산화하며 글리코겐의 합성과 분해를 조절한다. 글루카곤와 에피네프린은 둘 다 글리코겐의 분해를 촉진하지만 그 목적이 서로 다르다.

'생화학 > 생화학 (하)' 카테고리의 다른 글
| [생화학] 시트르산 회로 (The Citric Acid Cycle) (0) | 2022.08.09 |
|---|---|
| [생화학] 아세틸-CoA의 생성 (Production of Acetyl-CoA) (0) | 2022.08.06 |
| [생화학] 당분해와 포도당신생성 조절 (Regulation of Glycolysis and Gluconeogenesis) (0) | 2022.07.31 |
| [생화학] 대사경로의 조절 (Regulation of Metabolic Pathways) (0) | 2022.07.31 |
| [생화학] 발효 (Fermentation) (0) | 2022.07.31 |