단백질(Protein)은 세포에서 일어나는 거의 모든 과정을 중개한다. 그래서 모든 세포는―심지어 생물인지 논란이 있는 바이러스(Virus)조차도― 다양한 단백질을 세포 내에 갖고 있다.
단백질은 매우 복잡한 3차원 구조로 되어 있고, 이러한 3차원 구조는 단백질의 기능을 결정한다(structure defines function). 단백질의 3차원 구조는 긴 아미노산 사슬이 접힘으로써 형성되는데, 접힘을 결정하는 것은 단백질을 구성하는 아미노산 각각의 성질이다. 때문에 아미노산에 대해 아는 것은 단백질을 공부하는데, 더 나아가 단백질로 구성된 효소로 매개되는 생체 내 화학반응을 다루는 학문인 '생화학'을 공부하는데 있어 매우 중요하다.
아미노산(Amino acid)은 공통된 구조를 갖는 분자들을 일컫는 말이다. 단백질을 구성하는 것은 아미노산이지만, 모든 아미노산이 단백질을 구성하지는 않는다. 다만 생화학에서는 단백질의 구성 요소가 되는 아미노산, 그중에서 가장 중요한 표준 아미노산 20종에 대해 다룬다.

20종류의 표준 아미노산은 모두 α-아미노산이다.
α-아미노산은 중심 탄소 원자(α 탄소)에 1개의 수소기, 1개의 카복실기(Carboxyl group, COO-), 1개의 아미노기(Amino group, H3N+, NH3+), 1개의 곁사슬(R기, R group)을 갖는다.
표준 아미노산은 아미노산의 풀네임, 3글자의 약자, 1글자의 기호 3가지의 방식으로 표기된다. 예를 들어 가장 간단한 구조를 갖는 아미노산인 글라이신(Glycine)의 경우 3글자 약자는 Gly, 1글자 기호는 G이다.
왜 이렇게 3종류로 표기하냐면, 여러 분야에서 아미노산은 그것의 서열이 더 중요할 때가 많기 때문이다. 풀네임이 있음에도 웬만한 경우 AGTC로 축약해 쓰는 염기의 경우와 비슷하다. 자주 쓰이는 아미노산의 경우 아미노산 이름의 앞글자를 따지만, 20종류나 되기 때문에 앞글자가 겹치는 경우도 많아서 생물학자들이 나름 머리를 써 아미노산 별로 약어가 다 다르다. 풀네임과 축약어는 밑에서 아미노산을 분류할 때 병기해두었다.
20종류의 아미노산은 아미노산의 극성과 R기의 성질에 따라 분류할 수 있다. 아미노산의 분류 방식은 여러 가지가 있지만 본 글에서는 다음의 분류에 따라 아미노산을 소개할 것이다.
극성, 성질, 작용기, 소수성 상호작용 등 아미노산의 분류를 설명하는 데 쓰이는 여러 화학 용어들은 다음 글에서 한 번에 정리하도록 하겠다. 여기서는 아미노산들을 그냥 눈에 익히고 익숙해지는 데 의의를 두자.
아미노산의 구조식에서 주황색으로 칠해진 부분은 그 아미노산의 곁사슬이다.
1. 비극성, 지방족 R기 : Gly, Ala, Val, Leu, Ile, Pro, Met
위 7개의 아미노산은 비극성이며, 지방족의 곁사슬을 가진다. 지방족이란 고리 형태를 이루지 않는 긴 탄화수소 분자를 일컫는 말이다. 즉 이 분류에 속하는 아미노산들은 곁사슬로 '사슬 형태로 된 탄화수소'를 갖는다.
1) 글라이신 (Glycine, Gly, G)

글라이신은 가장 간단한 구조의 아미노산이다. 곁사슬로 수소 원자 단 하나를 갖고 있고, 때문에 지방족 아미노산끼리 일어나는 소수성 상호작용은 거의 없다. 가장 간단한 구조의 아미노산임에도 불구하고 생체 내에서 가장 큰 비중을 차지하지는 않는다. 이는 생체 내 물질들이 자연적으로 알아서 만들어지는 게 아닌, 특정한 기능을 수행하기 위해 만들어짐을 시사한다. (글라이신의 구조는 너무 간단해 생체 내에서 특정한 목적을 수행하기 힘들다.)
2) 알라닌 (Alanine, Ala, A), 발린 (Valine, Val, V)

알라닌은 글라이신의 곁사슬 수소가 메테인(CH3)으로 치환된 것이다. 생체 내에서는 알라닌이 가장 기본적인 아미노산이다. 거의 모든 아미노산은 알라닌을 주형으로 다른 작용기가 첨가되며 생체 내에서 합성된다.
발린은 알라닌에서 더 길어진 탄화수소 곁사슬을 갖는다. 생물학을 공부하다 보면 자주 접하게 되는 '겸상 적혈구 증후군'은 헤모글로빈의 단백질 사슬 중 6번째 아미노산이 발린으로 치환돼 생기는 유전병이다.
3) 류신 (Leucine, Leu, L), 아이소류신 (Isoleucine, Ile, I)

류신은 발린에서 더 길어진 탄화수소 곁사슬을 갖는다. 아이소류신은 류신과 같은 화학식을 갖지만 구조가 다른 이성질체이다. 위에서 언급한 발린과 류신, 아이소류신은 곁사슬의 성질이 비슷해 단백질에서 이들을 각각 따로 분리해내기가 어렵다.
4) 프롤린 (Proline, Pro, P), 메싸이오닌 (Methionine, Met, M)

글라이신부터 류신(아이소류신)까지는 탄화수소의 사슬이 길어지기만 했다면, 이들은 조금 특이한 구조를 갖는다.
프롤린은 특이하게도 곁사슬의 탄화수소가 아미노기와 결합해 고리 형태를 이룬다. 때문에 분자의 회전이 매우 어려워져 프롤린이 함유된 폴리펩타이드는 구조적 유연성이 매우 낮다.
메싸이오닌은 곁사슬의 긴 탄화수소 사이에 황(S)이 함유되어 있다. 메싸이오닌은 단백질의 번역 과정에서 개시코돈(AUG)이 지정하는 아미노산이라 모든 초기 단백질은 메싸이오닌을 포함하고 있다. (보통 단백질 후처리 과정에서 메싸이오닌은 떨어져 나간다.)
2. 방향족 R기 : Phe, Tyr, Trp
방향족이란 벤젠고리 구조를 갖는 탄화수소를 일컫는다. 이 분류에 속한 아미노산은 자외선을 흡수하는데, 이는 단백질을 연구하는 데 있어 중요하다.
1) 페닐알라닌 (Phenylalanine, Phe, F), 타이로신 (Tyrosine, Tyr, Y)

페닐알라닌은 알라닌에 페닐기, 즉 벤젠고리가 첨가된 것이다. 타이로신은 페닐알라닌 벤젠 고리의 끝부분이 수산화기(-OH)로 치환된 구조를 갖는다.
페닐알라닌은 생체 내에서 대개 타이로신으로 전환 후 저장된다. 이 과정에 유전적으로 문제가 있을 경우 페닐케톤뇨증(PKU) 등의 페닐알라닌이 쌓이는 질병이 발병한다. 페닐알라닌이 생체 내에 과다하면 이것이 뇌에 쌓여 중추신경계에 손상을 줄 수 있다.
2) 트립토판 (Tryptophan, Try, W)
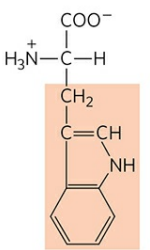
트립토판은 알라닌에 인돌기(-C=CHNHC6H4)라는 아주 복잡한 작용기가 붙은 것이다. 인돌은 엄청난 악취를 만들어내는데, 단백질이 잔뜩 함유된 음식을 먹으면 방귀나 대변 냄새가 지독해지는 것이 트립토판에 함유된 인돌기 때문이다.
3. 극성, 비전하 R기 : Ser, Thr, Asn, Gln, Cys
이 분류의 아미노산은 극성이지만 전하를 갖지는 않는다. 이들이 극성인 이유는 곁사슬 끝부분에 수산화기(-OH), 아마이드기(-NH2), 설프하이드릴기(-SH)와 같은 극성 작용기를 갖고 있기 때문이다.
1) 세린 (Serine, Ser, S), 트레오닌 (Threonine, Thr, T)
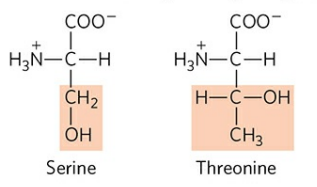
세린과 트레오닌은 작용기에 수산화기를 가져 극성을 띤다.
2) 아스파라진 (Asparagine, Asn, N), 글루타민 (Glutamine, Gln, Q)
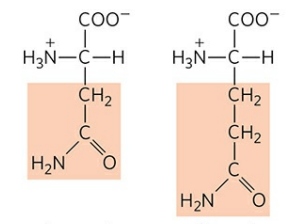
아스파라진과 글루타민은 작용기에 아마이드기를 가져 극성을 띤다. 아스파라진은 최초로 발견된 아미노산이다. 이들은 각각 아스파트산, 글루탐산으로 전환될 수 있다.
3) 시스테인 (Cysteine, Cys, C)
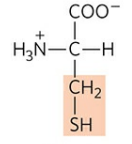
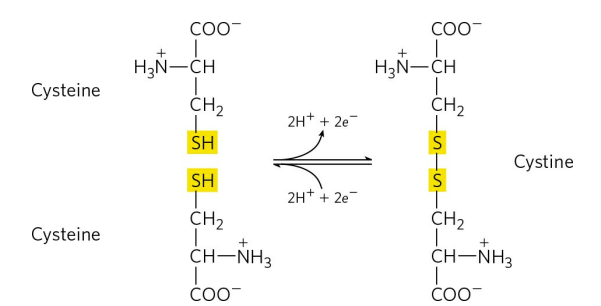
4. 양전하 R기 : Lys, Arg, His
이 분류의 아미노산은 수용액에서 양전하를 가지며, 염기성을 띤다.
1) 라이신 (Lysine, Lys, K), 아르지닌 (Arginine, Arg, R)
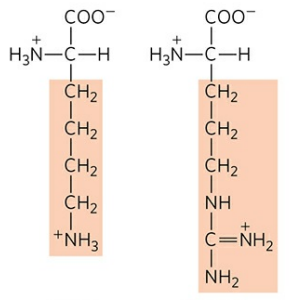
라이신과 아르지닌은 곁사슬 끝부분에 아미노기를 가져 양전하를 띤다. 아르지닌은 생체 내 요소 회로에서 매우 중요한 역할을 한다.
2) 히스티딘 (Histidine, His, H)
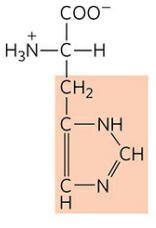
히스티딘은 곁사슬로 이미다졸기(Imidazol group)을 갖는다. 히스티딘은 양전하를 띠기는 하지만 곁사슬의 pKR값이 거의 중성에 가까워 효소에서 H+의 이동을 매우 쉽게 촉매할 수 있다.
5. 음전하 R기 : Asp, Glu
이 분류의 아미노산은 수용액에서 음전하를 가지며, 산성을 띤다.
1) 아스파트산 (Aspartate, Asp, D), 글루탐산 (Glutamate, Glu, E)
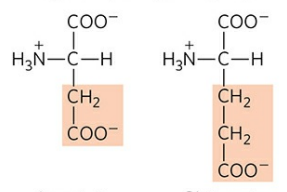
이들은 곁사슬 끝에 제2의 카복실기를 갖고 있다. 위에서 언급했듯 이들은 각각 아스파라진, 글루타민으로 전환이 가능하다.
이로써 20종의 표준 아미노산의 구조와 분류를 알아보았다. 이 외에도 셀레노시스테인, 오르니틴, 시트룰린 등 표준 아미노산에 속하지 않는 아미노산도 매우 많이 존재한다.
각각의 아미노산은 생체 내에서 여러 기능을 수행한다. 앞으로 생화학 전반에 걸쳐 아미노산들의 여러 기능, 역할 등을 알아볼 것이다.
다음 글에서는 아미노산이 갖는 여러 화학적 특징들에 대해 알아보도록 하자.