시트르산 회로(Citric acid cycle)는 트라이카복실산 회로(Tricarboxylic acid cycle, TCA 회로) 혹은 크랩스 회로(Krebs cycle)라 불리기도 한다. 크랩스는 시트르산 회로의 발견자이다.

시트르산은 세 개의 카복실산(-COO- 혹은 COOH)을 갖는 6탄소 화합물이다. 시트르산 회로를 거치며 시트르산의 카복실기 2개는 CO2의 형태로 방출된다. TCA 회로의 명칭은 여기서 왔다.
시트르산 회로의 첫단계는 옥살아세트산(Oxaloacetate)이 아세틸-CoA로부터 아세틸기를 전달받아 시트르산(Citrate)을 형성하는 것이다. 아세틸기를 전달한 CoA는 다시 PDH 복합체로 돌아간다. 이후 시트르산은 여러 단계를 거쳐 두 분자의 CO2, 3분자의 NADH, 1분자의 FADH2와 GTP를 방출하며 옥살아세트산으로 다시 전환된다. 옥살아세트산은 다시 아세틸-CoA와 반응하며 회로의 두번째 회전을 시작한다.
이번 글에서는 시트르산 회로 각 반응의 기전과 회로가 어떻게 조절되는지에 대해 알아보도록 하자.

1. 시트르산 회로 개요

시트르산 회로의 첫 반응은 앞서 언급했듯 옥살아세트산과 아세틸-CoA의 반응이다. 이 반응으로 형성된 시트르산은 차례로 다음의 중간체를 거친다.
① 시트르산(Citrate)
② 아이소시트르산(Isocitrate)
③ α-케토글루타르산(α-Ketoglutarate)
④ 석시닐-CoA(Succinyl-CoA)
⑤ 석신산(Succinate)
⑥ 퓨마르산(Fumarate)
⑦ 말산(Malate)
⑧ 옥살아세트산(Oxaloacetate)
위 중간체는 시트르산 회로의 중간 대사체일 뿐만 아니라, 생체 내 다양한 반응에서 합성의 전구체, 대사체, 운반체 등으로 이용된다. 각 반응은 모두 미토콘드리아 내부에서 일어나며, 시트르산 회로 1회전은 결과적으로 아세틸-CoA의 아세틸기 탄소 2개가 CO2로 산화되는 셈이 된다.
그렇다면 왜 아세틸기는 그 자체로 산화되지 않고 복잡한 회로를 거치는가? 아세틸기의 구조를 살펴보면 그 이유를 알 수 있다.

아세틸기의 한쪽 끝은 메틸기(-CH3)이기 때문에, 아세틸기가 산화되면 메테인(CH4)과 이산화탄소(CO2)로 산화된다. 메테인은 매우 안정된 분자이므로, 생체 내에서 아세틸기의 산화로 생성된 메테인을 다시 이산화탄소로 완전 산화시킬 수 있는 효소는 존재하지 않는다. (고메테인 환경에서 사는 메탄균은 예외이다.) 하지만 메틸기를 메틸렌기(-CH2-)로 바꾸면 이는 쉽게 생체 내에서 대사될 수 있다. 즉, 아세틸-CoA와 옥살아세트산의 결합은 아세틸기의 메틸기를 시트르산의 메틸렌기로 바꾸는 과정이라 이해할 수 있다.
이제부터는 시트르산 회로 각 단계에 대한 사항을 보다 자세히 살펴보자.
2. 시트르산 회로의 반응
1) 시트르산의 생성

옥살아세트산과 아세틸-CoA는 시트르산 생성효소(Citrate sunthase)에 의해 시트르산으로 축합된다. 이 반응에서 물이 한 분자 첨가되며, CoA는 방출되어 PDH 복합체로 돌아간다.

우선 옥살아세트산이 시트르산 생성효소에 결합하고 나면, 시트르산 생성효소의 아세틸-CoA 결합자리가 밖으로 드러난다. 그 후 복잡한 일련의 과정을 거쳐 아세틸-CoA의 아세틸기를 옥살아세트산과 결합시켜 시트로일-CoA(Citroyl-CoA)라는 중간체를 형성하고, 물을 첨가해 CoA를 분리해 방출시킨다.
2) 아이소시트르산의 생성

시트르산은 아코니트산 수화효소(Aconitate hydratase)에 의해 아이소시트르산으로 전환된다. 이 반응은 cis-아코니트산(cis-Aconitate)이라는 중간체를 거친다. 이 반응은 양의 표준 자유에너지 값을 갖고 있지만, 일반적인 상황에서 아이소시트르산은 생성된 즉시 다음 반응을 거쳐 소모되므로 실제 자유에너지 값은 0에 가깝다.
3) 아이소시트르산의 산화 및 탈카복실화
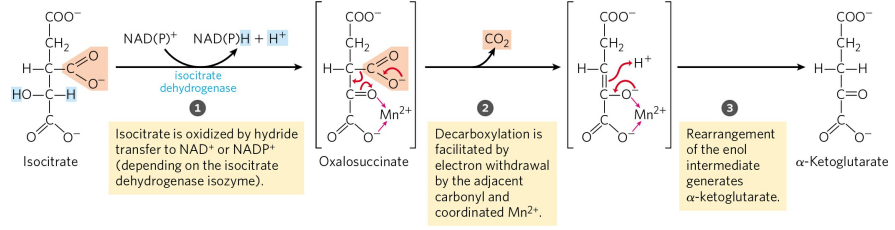
아이소시트르산 탈수소효소(Isocitrate dehydrogenase)에 의해 아이소시트르산은 산화 및 탈카복실화를 거쳐 α-케토글루타르산을 형성한다. 이 반응은 시트르산 회로에서 NAD+를 필요로 한다. 특이하게 세포질에서 이 반응은 NADP+를 필요로 하고, 인산 오탄당 경로에서처럼 NADPH의 생성을 위해 일어난다.
α-케토글루타르산은 글루탐산의 아미노기가 케톤기로 치환된 글루탐산의 케톤체(Ketone body)다. 둘의 전환은 나중에 배울 아미노산의 이화 과정에서 매우 중요한 역할을 한다.
4) α-케토글루타르산의 산화 및 탈카복실화
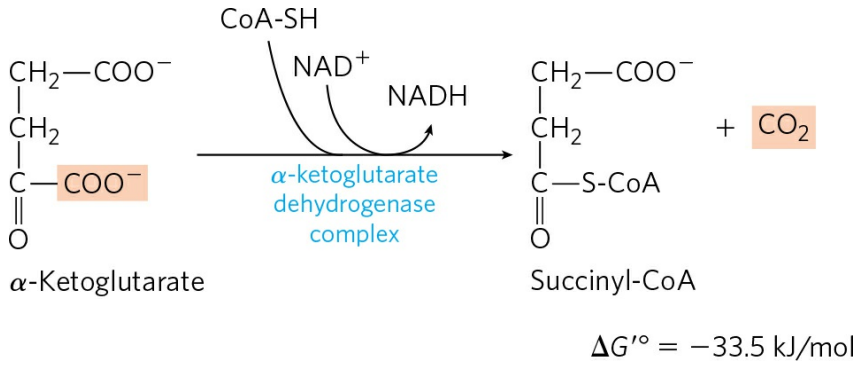
α-케토글루타르산은 α-케토글루타르산 탈수소효소 복합체(α-Ketoclutarate dehydrogenase complex)에 의해 탈카복실화되며, 동시에 CoA가 결합해 석시닐-CoA를 형성한다. 이 효소의 기전은 PDH 복합체의 기전과 매우 유사하다.
5) 석시닐-CoA의 전환
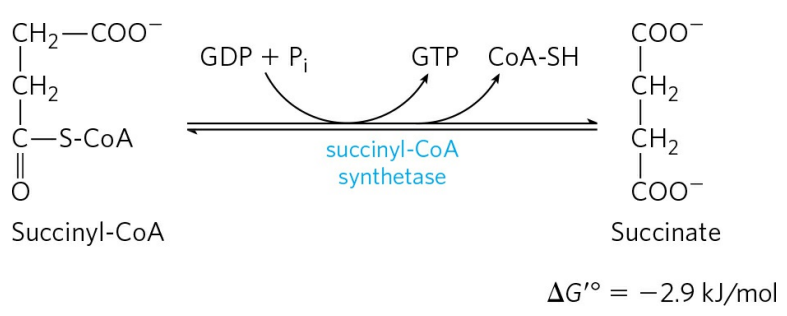
석시닐-CoA는 석시닐-CoA 합성효소(Succinyl-CoA synthetase)에 의해 석신산으로 전환된다. 이때 CoA가 방출되며, GTP 또는 ATP 한 분자를 합성한다. 이는 당분해에서와 같은 기질 수준 인산화이다.
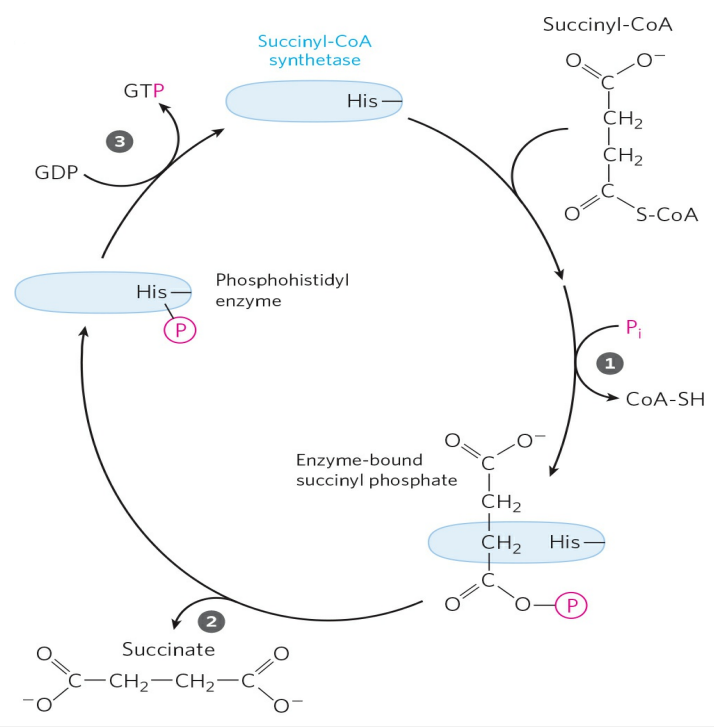
우선, 석시닐-CoA의 CoA는 가인산분해되어 방출된다.(①) 그 후, 석시닐-인산의 인산기는 효소의 His 잔기로 옮겨지고, 인산을 전달한 석신산은 효소 밖으로 방출된다.(②) 효소에 결합한 인산기는 GDP(또는 ADP)에 전달되어 GTP(또는 ATP)를 합성한다.(③) 만약 GTP를 합성했을 경우, GTP는 이인산 뉴클레오사이드 인산화효소(Nucleoside diphosphate kinase)에 의해 ATP로 전환된다.
6) 석신산의 산화
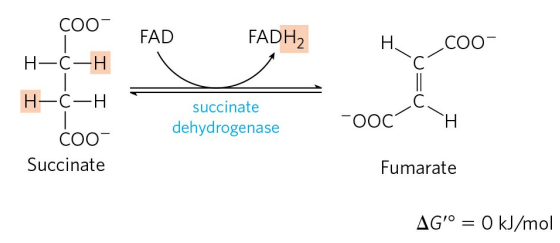
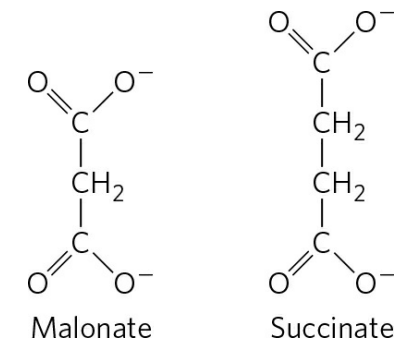
석신산은 석신산 탈수소효소(Succinate dehydrogenase)에 의해 퓨마르산으로 산화된다. 이 과정에서 FADH2를 한 분자 생성한다. 석신산의 유사체인 말론산(Malonate)은 석신산 탈수소효소를 경쟁적으로 억제한다.
7) 퓨마르산의 수화
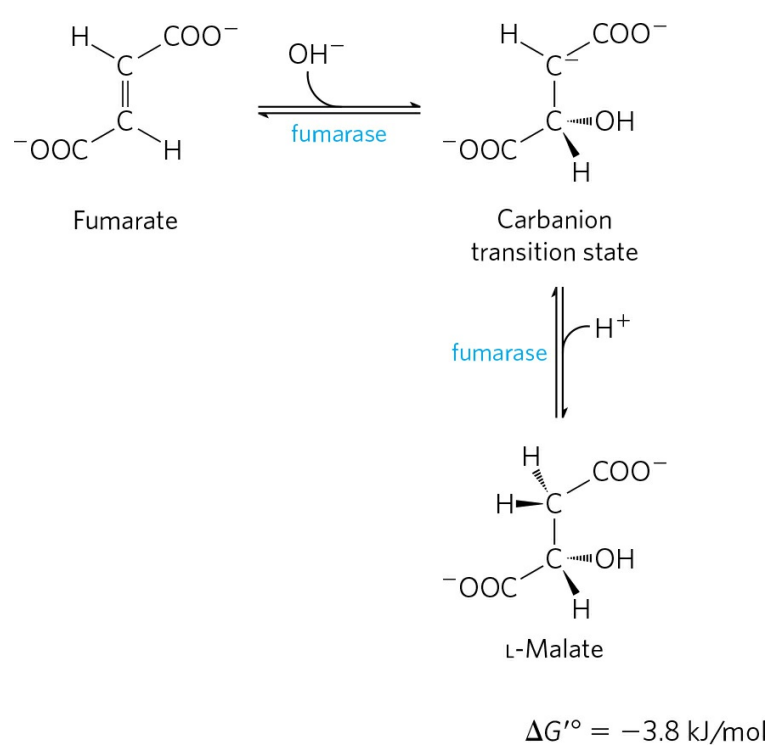
퓨마르산은 퓨마르산 수화효소(Fumarate hydratase, Fumarase)에 의해 말산으로 수화된다.
8) 말산의 산화
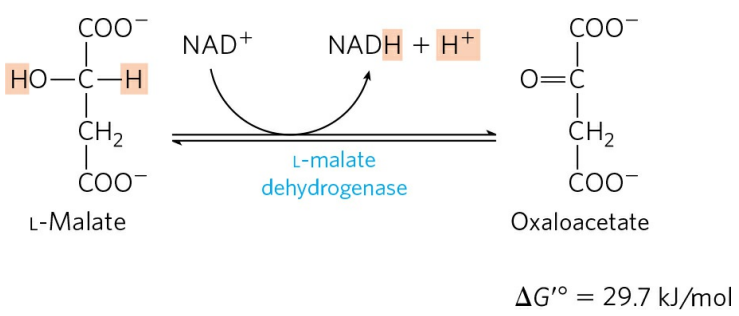
말산은 L-말산 탈수소효소(L-malate dehydrogenase)에 의해 산회되어 옥살아세트산을 생성한다. 이 반응은 매우 큰 양의 표준 자유에너지 값을 갖고 있는데, 옥살아세트산의 세포 내 농도는 매우 낮아 반응의 실제 자유에너지 값은 음수로 유지된다.
3. 시트르산 회로의 결과
시트르산 회로 1회전의 생성물은 다음과 같다.
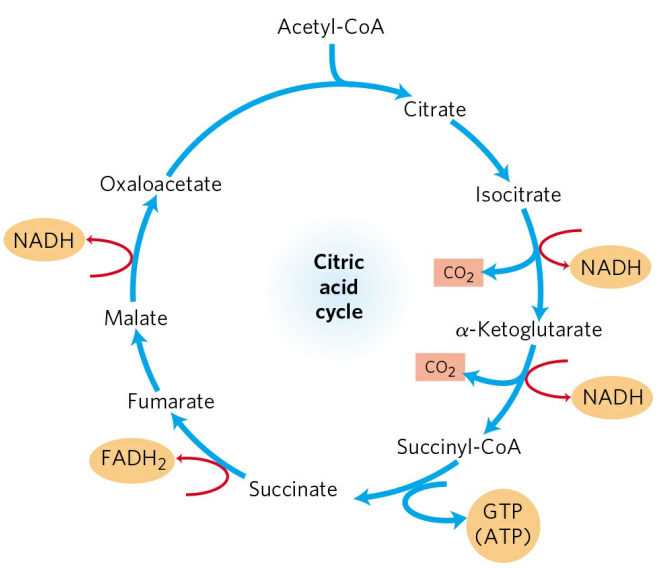
3분자의 NADH, 2분자의 FADH2, 1분자의 GTP(ATP)가 생성된다. 나중에 더 자세히 다루겠지만, 산화인산화에서 NADH는 2.5분자, FADH2는 1.5분자의 ATP를 생성한다. 결과적으로 1분자의 포도당은 당분해, 시트르산 회로, 산화인산화를 거쳐 약 30~32분자의 ATP를 생성하게 된다.
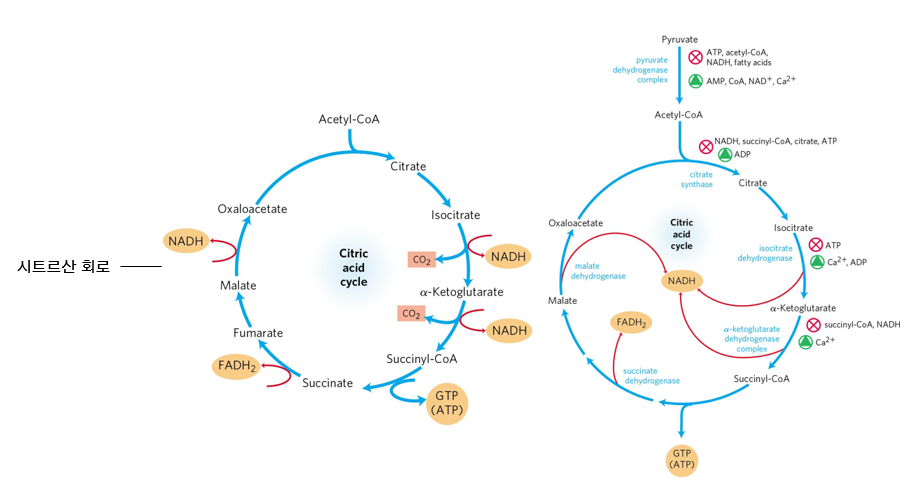
4. 시트르산 회로의 조절
시트르산 회로는 크게 네 단계에서 조절된다.
① 피루브산 → 아세틸-CoA
② 옥살아세트산 + 아세틸-CoA → 시트르산
③ 아이소시트르산 → α-케토글루타르산
④ α-케토글루타르산 → 석시닐-CoA
시트르산 회로 전체 반응의 속도를 조절하는 것은 ①, PDH 복합체의 반응이다. 모든 조절 단계는 시트르산 회로의 산물(ATP, NADH)에 의해 억제되고, 기질(ADP, NAD+)에 의해 촉진된다. PDH 복합체는 특히 에너지가 많다는 신호(아세틸-CoA, 지방산 등)에 의해 추가로 억제되고, 에너지가 부족하다는 신호(AMP, CoA 등)에 의해 추가로 촉진된다.
시트르산 회로의 중간체들에 대한 사항은 꼭 알아두자. 나중에 배울 지방산, 아미노산의 이화, 생합성 경로 등에서 꾸준히 나오는 분자들이다.
'휴지통' 카테고리의 다른 글
| 카보닐, 아실, 알데하이드, 케톤 (Carbonyl, Acyl, Aldehyde, Ketone) (0) | 2022.08.13 |
|---|---|
| [생화학] 지방의 소화, 동원 및 운반 (Digestion, Mobilization, and Transport of Fats) (0) | 2022.08.10 |
| [생화학] 아세틸-CoA의 생성 (Production of Acetyl-CoA) (0) | 2022.08.06 |
| [생화학] 글리코겐 대사의 조절 (Regulation of The Metabolism of Glycogen) (0) | 2022.08.03 |
| [생화학] 당분해와 포도당신생성 조절 (Regulation of Glycolysis and Gluconeogenesis) (0) | 2022.07.31 |



