대사 조절은 생화학의 핵심 주제 중 하나다. 세포 내에서 일어나는 수많은 반응들 중 '조절(Regulation)'을 피할 수 있는 반응은 없다. 대사(Metabolism)란 앞서 언급했듯, 세포 내에서 일어나는 모든 화학반응의 총체다. 거의 모든 대사반응은 세포 내에서 효소를 필요로 한다.
대사경로의 원리를 배우기 위해 우선 일반적인 대사경로의 조절 방식을 알아보고, 앞서 배웠던 '포도당 대사'에서의 조절, 그 후 글리코겐 대사의 조절을 살펴보도록 하자.

1. 대사경로의 조절 개요
세포의 환경은 때론 급격히 변화한다. 우리가 일상적으로 운동을 할 때, 근육 세포에서 ATP의 요구량은 수초 내에 100배나 증가한다. 우리는 매일 다른 음식을 먹으므로, 매일 얻는 영양소의 공급은 간헐적이고 또 비균일하다. 그러한 환경 변화 속에서 세포는 항상성(Homeostasis)을 유지하기 위해 대사를 조절한다. 즉, 대사 조절의 목적은 항상성을 지켜 세포가 항정상태(Steady state)를 유지하도록 하는 것이다. 항상성 유지의 실패는 질병, 더 나아가 세포의 죽음을 초래한다.
가장 대표적인 항상성 유지의 기전 중 하나는 혈액의 포도당 농도, 혈당이다. 포도당은 음식을 섭취할 때 혈액으로 유입되고, 혈액에서 다시 조직으로 유입된다. 음식의 섭취량이 많아 혈당이 높아질 경우, 개체는 조직으로의 포도당 유입량도 증가시켜 혈당을 유지한다. 반대로, 음식의 섭취량이 적어 혈당이 떨어질 경우에는 포도당을 조직에서부터 혈액으로 뽑아낸다.
그렇다면 세포는 어떻게 대사경로를 조절할까?
2. 대사경로의 조절 기전
앞서 거의 모든 대사반응은 효소를 필요로 한다고 했다. 때문에, 대사경로를 조절하기 위해서는 효소를 조절하는 것이 필수적이다. 이는 효소의 수를 변화시키거나, 효소의 촉매 활성을 변화시킬 수 있다.
1) 효소의 수 조절
세포 내에서 효소는 기본적으로 항상 존재하고, 동시에 재활용된다. 즉, 항상 일정량의 효소는 분해되고, 또 합성되고 있다. 효소의 수를 조절하는 것은 효소의 합성과 분해의 상대적 속도를 조절하는 것과 같다. 효소의 수를 조절하는 데에는 대표적으로 6가지 기작이 있다.

① 외부 신호
외부 신호는 다양한 호르몬(인슐린, 에피네프린), 신경계의 신호(아세틸콜린), 성장인자 혹은 사이토카인(Cytokine)에 의해 유발된다. 외부 신호는 세포 내 대사경로를 조절하기 위해 다양한 기전에 영향을 미친다.
② 전사인자 활성화
전사인자(Transcription factors)는 세포의 핵 내에 들어있는 단백질이다. 전사인자는 특정 유전자의 전사(Transcription)를 촉진한다. 특정 유전자의 전사는 곧 특정 효소의 합성 속도 변화를 의미한다. 여기서 전사되는 유전자가 암호화하는 단백질은 효소 그 자체일 수도, 전사인자일 수도, 혹은 다음에 나오는 다른 조절분자일 수도 있다.
당분해 과정처럼 여러 효소가 하나의 대사 경로에 포함되는 경우에, 하나의 외부 신호가 여러 전사인자를 동시에 활성화할 수 있다. 반대로, 하나의 유전자가 여러 전사인자에 의해 조절받을 수도 있다.

③ mRNA의 안정성
세포 내에는 항상 RNA를 분해하는 리보핵산분해효소(Ribonuclease)가 존재한다. 전사인자의 활성화가 mRNA의 합성 속도를 조절한다면, 핵 밖으로 나온 mRNA의 안정성은 mRNA 분해 속도를 조절한다. 다만, mRNA의 수가 n배 증가했다고 해서 항상 단백질 산물도 n배 증가하는 것은 아니다.
④ 번역 속도 조절
mRNA가 리보솜에서 번역되는 속도도 조절될 수 있다. 이는 여러가지 요소에 의존하며, 나중에 보다 자세히 다루도록 하자.

⑤ 효소의 분해
앞서 ①~④ 기전은 효소의 합성 속도를 조절하는 것이었다. 효소의 분해 속도는 효소의 종류마다, 그리고 세포 내 환경마다 달라진다. 단백질을 분해하는 세포소기관인 프로테아솜(Proteasome)은 유비퀴틴(Ubiquitin)이 결합한 단백질을 분해하는데, 때문에 세포는 단백질, 효소의 분해 속도를 조절할 수 있다.
효소를 만들고 나서 다시 분해하는 건 언뜻 보면 쓸모 없는 일처럼 보일 수 있다. 하지만 효소의 합성과 분해 과정을 끊임없이 유지하는 것이 급격한 환경 변화에 대응하는 데에는 더 효과적이다. 하나의 효소가 1년 동안 유지되고, 그동안 새로운 효소의 합성이 멈춘다면, 갑작스럽게 효소가 많이 필요한 환경이 되거나, 그 효소가 필요하지 않을 환경이 될 경우 효소의 양을 조절하기가 어렵다. 때문에 세포는 끊임없이 효소를 만들어내고, 또 분해하는 것이다.
⑥ 효소의 구분
효소를 분해하지 않고, 소포체 내에 가두어 기질과 접촉하지 못하게 하는 방식으로 효소의 수를 조절할 수도 있다.
2) 효소의 촉매 활성 조절
일단 효소가 합성되고 나면, 그 후 효소의 활성은 다시 여러 가지 방식을 통해 조절될 수 있다.

⑦ 기질 농도 조절
모든 효소는 기질 농도에 민감하다. 미하엘리스-멘텐 식을 기억해보자.
$ V_0 = {V_{max}[S] \over K_m + [S]} $
[S]가 매우 낮을 때([S] <<< Km), 위 식은 아래와 같아지고, 효소의 반응속도는 기질 농도 [S]에 정비례하게 된다.
$ V_0 = {V_{max}[S] \over K_m} $
보통 기질의 세포 내 농도는 Km보다 낮다. 하지만 ATP로부터의 인산기 전달 반응, NADPH를 이용한 산화-환원 반응 등에서는 기질의 농도가 Km보다 높다. 이 경우에는 기질 농도가 효소 활성에 별다른 영향을 미치지 않는다. (효소가 포화되었기 때문)
⑧ 리간드 농도 조절
효소는 기질 외에 다른 리간드들과 결합할 수 있다. 이때, 리간드의 결합이 효소의 활성을 조절할 때 이를 입체다른자리 효과(Allosteric effect)라 하고, 이때의 리간드를 입체다른자리 조절자(Allosteric modulator)라 한다. 입체다른자리 조절자에 의한 효소 활성 조절은 생화학 (상) '단백질의 기능'과 '효소' 부분에 자세하게 다뤄져 있다.
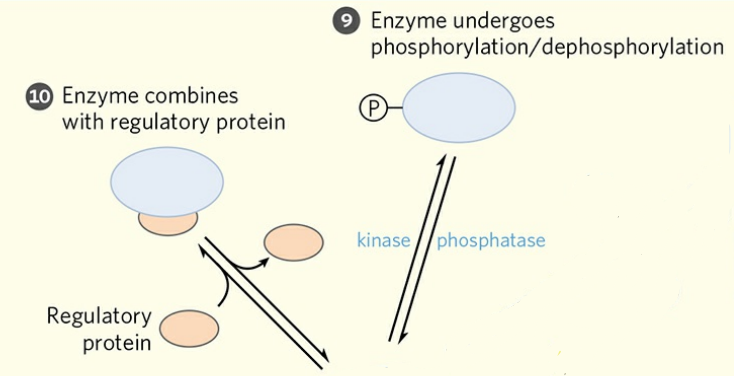
⑨ 효소의 인산화
인산화는 효소에서도 일반적인 조절 기전 중 하나이다. 진핵세포 단백질의 절반 이상이 특정 상황에서 인산화된다. 인산화에 의한 효소-인산 공유결합은 효소 구조의 변화를 초래한다.
⑩ 조절 단백질
조절 단백질은 효소들과 결합, 해리되며 효소를 조절한다.
위 과정들은 상호 배타적이지 않다. 1개의 효소 작용을 조절하기 위해 다양한 조절 기전이 이용되는 건 매우 흔한 일이다.
3. 대사경로의 조절 원리
A로부터 D를 생성하는 다음 반응을 생각해보자.
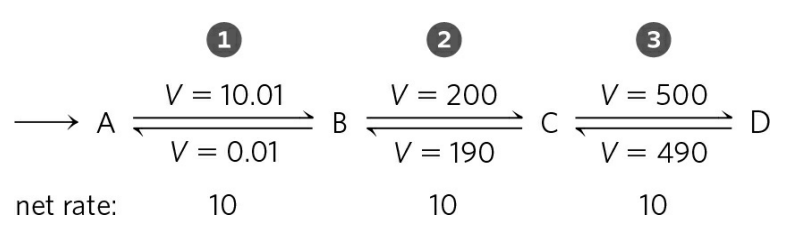
이 반응은 B, C라는 두 개의 중간체를 거친다.
B → C, C → D 반응은 정반응과 역반응의 속도 비율 차이가 그리 크지 않다. 단지, 정반응이 역반응보다 속도가 10 빠를 뿐이다. C, D의 농도가 증가한다면 이 반응은 쉽게 반대 방향으로 역전될 수 있다.
반면, A → B 반응은 위 두 반응과 똑같이 정반응 속도가 10이지만, 정반응과 역반응 속도 비율이 1,000배 가깝게 차이가 난다. 이 경우, 정반응이 역반응보다 훨씬 우세하다.
위 A → B와 같은 반응을 평형으로부터 멀리 떨어진 반응이라고 부르고, A → D 대사 과정을 조절할 때 A → B 반응은 조절의 핵심 단계가 된다. 이들의 반응 방향에 의해 평형에 가까운 B → C, C → D 반응의 방향이 정해지고, 전체 방향이 A → D 방향으로 가도록 한다.
A와 B가 평형 상태를 이룬다면, A → D 반응은 더 이상 우세하게 일어나지 않는, 쉽게 역방향으로 돌아갈 수 있는 반응이 된다. 때문에, 세포는 이를 막기 위해 A와 B의 농도 차이를 유지하기 위해 애쓴다. 만약 A → D 반응을 멈추어야 할 경우, A와 B 농도를 비슷하게 맞춘다. 때문에 A → B 반응은 위 반응의 핵심 조절 단계가 된다.
4. AMP와 ATP
반면, 위와 같은 상황에서 A와 B의 농도 차이를 무조건 유지해야 하는 경우가 있다. ATP와 AMP가 그 대상이다.
ATP의 ΔG˚는 -30.5 KJ/mol이다. 앞서 언급했지만, 실제 세포 내 환경에서 ATP의 ΔG는 이보다 조금 더 높다. 이는 세포 내 ATP의 농도가, ATP의 분해 산물인 ADP, AMP의 농도보다 훨씬 높기 때문에 유지될 수 있는 것이다.
만약 ATP의 농도가 ADP, AMP와 비슷하다면 ATP의 ΔG는 ΔG˚ 값과 동일해질 것이고, 여기서 ATP 농도가 더 줄어든다면 ATP의 ΔG는 점점 0에 가까워질 것이다. 즉, ATP의 농도 감소는 그 자체로 에너지가 고갈되었다는 것뿐만 아니라, ATP가 에너지로써 기능할 수 있는 잠재력을 소실한다는 뜻이다. 때문에 세포는 세포 내 ATP 농도를 높게 유지하기 위해 엄청나게 많은 기전을 갖고 있다.
$ ATP → ADP + P_i $
위 반응의 결과로 생성된 ADP는 다시 아데닐산 인산화효소(Adenylate kinase)에 의해 다음과 같은 반응을 거친다.
$ 2ADP → AMP + ATP $
즉, ATP가 소모되면, 결과적으로 AMP의 농도가 늘어난다. n개의 ATP가 소모될 때 n개의 AMP가 생기지만, [AMP]는 [ATP]에 비해 매우 낮기 때문에 AMP 농도의 상대변화는 ATP 농도의 상대변화보다 수백 배 더 크다.
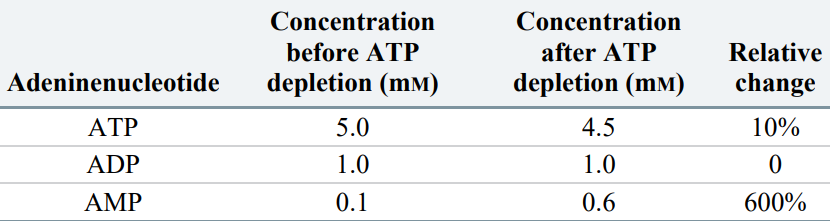
따라서 많은 [ATP] 조절 과정은 [ATP]보다 [AMP]에 의존적이다. AMP에 의해 조절되는 중요 과정 중 하나가 AMP-활성 단백질 인산화효소(AMP-activated protein kinase, AMPK)다. AMPK는 특정 조직의 호르몬 분비를 조절하거나, 합성 및 분해를 촉진해 개체가 ATP를 더 소비하지 않고, 더 많은 영양분을 섭취하도록 돕는다.
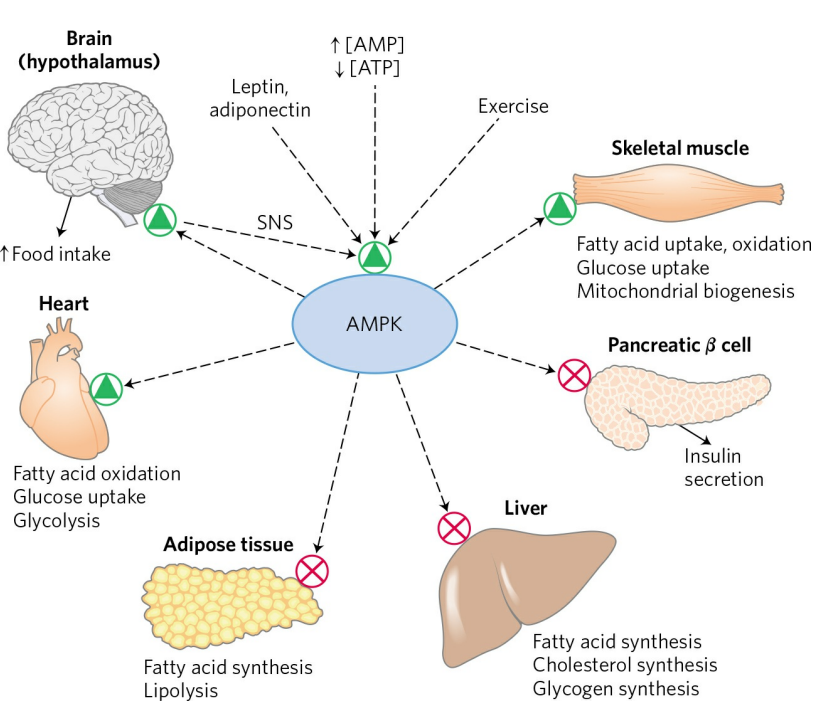
정리하자. 세포는 항상성을 유지하기 위해 다양한 대사경로의 조절 기전을 이용한다. 이때, 조절의 핵심 단계는 대개 평형으로부터 떨어져 있는 반응이다. 세포 내에서 가장 중요한 물질인 ATP는 AMP의 농도에 의해 조절되는데, 이때 AMPK가 기능한다.

'휴지통' 카테고리의 다른 글
| [생화학] 글리코겐 대사의 조절 (Regulation of The Metabolism of Glycogen) (0) | 2022.08.03 |
|---|---|
| [생화학] 당분해와 포도당신생성 조절 (Regulation of Glycolysis and Gluconeogenesis) (0) | 2022.07.31 |
| [생화학] 발효 (Fermentation) (0) | 2022.07.31 |
| [생화학] 인산 오탄당 경로 (Pentose phosphate Pathway) (0) | 2022.07.31 |
| [생화학] 포도당신생성 (Gluconeogenesis) (0) | 2022.07.31 |



