단백질(Protein)은 모든 세포에 들어 있는 가장 풍부한 거대분자다. 단백질의 기본 구성 단위는 아미노산(Amino acid)이다. 아미노산은 펩타이드 결합(Peptide bond)을 통해 서로 연결되어 폴리펩타이드(Polypeptide)를 형성한다.

탄수화물의 기본 구성 단위인 단당류, 지방의 기본 구성 단위인 지방산과 글리세롤처럼, 단백질의 기본 구성 단위인 아미노산 또한 이화 반응을 통해 에너지를 생성할 수 있다. 아미노산으로부터 얻는 에너지의 비율은 생물 종류와 대사 조건에 따라 매우 다르다. 식이 대부분이 단백질인 육식동물은 에너지의 대부분을 아미노산으로 얻는 반면, 초식동물은 에너지의 대부분을 식물에서 유래한 탄수화물로 얻는다.
모든 에너지 생성 이화 반응의 중심은 앞서 배웠던 시트르산 회로(Citric acid cycle)다. 시트르산 회로로 유입되기 위해 포도당을 비롯한 단당류는 당분해(Glycolysis)를 거치고, 지방산은 β 산화(β Oxidation)를 거친다. 아미노산 또한 아미노산의 탄소 골격이 시트르산 회로로 유입되기 위해 추가적인 과정을 거친다.

표준 아미노산 20종은 모두 이화 경로가 다르지만, 공통적으로 아미노기(-NH3+)가 제거될 필요가 있다. 제거되어 수용액 속에 존재하는 암모늄 이온(NH4+), 혹은 암모니아(NH3)는 체내에 매우 유해하다. 이들은 정확한 조절 기전을 통해 몸 밖으로 배출되거나 생합성에 이용된다.
이번 글에서는 아미노산으로부터 유래된 아미노기가 어떻게 운반되고 대사되는지에 대해 알아보도록 하자. 이후 요소로 전환된 아미노기의 배설을 다룬 후, 20종 아미노산 각각이 정확히 어떤 대사 경로를 거치는지에 대해 공부할 것이다.

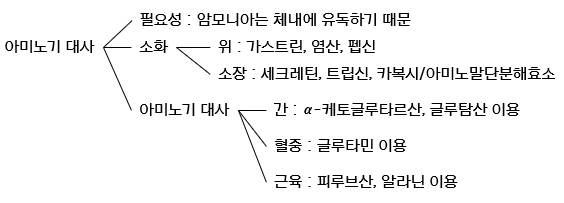
1. 단백질의 소화
우선 식이로 섭취된 단백질에서부터 출발해보자. 단백질은 육류, 생선, 계란 등에 풍부하다. 섭취된 단백질은 위장에서 1차적으로 소화되고, 소장에서 최종적으로 소화된다. 단백질 소화의 간략한 모식도는 다음과 같다.

위 과정을 세부적으로 살펴보자.
1) 위장에서의 소화

위장으로의 단백질 유입은 위 점막을 자극해 호르몬 가스트린(Gastrin), 염산(HCl), 펩시노젠(Pepsinogen) 분비를 촉진한다. 가스트린은 위 말단에서 위산 분비와 이자액 생산, 소장과 대장의 움직임을 촉진한다. 염산의 분비로 인한 낮아진 pH는 구단백질의 펼침을 유도해 단백질이 보다 쉽게 단백질분해효소와 접촉할 수 있게끔 한다.
펩시노젠은 단백질분해효소인 펩신(Pepsin)의 비활성 전구체[효소원(Zymogen)이라 부르기도 함]이다. 펩시노젠은 낮은 pH에서 자가절단 활성을 가져 스스로 활성형인 펩신으로 전환된다. 펩신은 류신과 방향족 아미노산의 아미노 말단에서 펩타이드 결합을 가수분해해 긴 펩타이드 사슬을 짧은 펩타이드 사슬로 절단한다.
2) 소장에서의 소화

위 내용물이 십이지장으로 유입되면 낮은 pH는 호르몬 세크레틴(Secretin)의 분비를 촉진한다. 세크레틴은 이자액의 분비를 촉진한다. 이자액의 중탄산염(HCO3-)은 위산을 중화시켜 pH를 약 7까지 높인다. 동시에 트립시노젠(Trypsinogen), 카이모트립시노젠(Chymotrypsinogen), 프로펩타이드카복시말단분해효소 A와 B(Procarboxypeptidase A and B)의 분비를 촉진한다. 이들은 모두 효소원이다. 트립시노젠은 소장 세포에서 창자 펩타이드분해효소에 의해 활성형인 트립신으로 전환된다. 트립신은 스스로 트립시노젠의 전환을 양성 피드백하며, 동시에 카이모트립시노젠, 프로펩타이드카복시말단분해효소를 활성화한다.
트립신과 카이모트립신은 펩신과는 다른 아미노산 특이성을 갖고 있어 절단된 펩타이드는 보다 작은 펩타이드 사슬로 다시 절단된다. 이후, 작은 펩타이드는 소장에서 펩타이드카복시말단분해효소 A와 B, 펩타이드아미노말단분해효소(Aminopeptidase)에 의해 아미노산으로 완전히 분해된다. 다만, 케라틴과 같은 일부 섬유 단백질은 완전히 소화되지 않고 배출된다.
단백질 소화에는 왜 비활성 전구체를 활성화하는 과정을 필요로 할까? 이는 단백질 분해효소가 평상시 외분비세포를 공격하는 것을 막기 위함이다. 이것을 막지 못한다면 단백질 분해효소가 췌장조직 등을 공격해 극심한 통증과 조직 손상을 일으켜 급성 췌장염(Acute pancreatitis)를 유발한다.
2. 간에서의 아미노기 전달
소화로 생성된 아미노산은 소장의 상피세포 내로 유입된 후, 모세혈관을 통해 간으로 이동한다. 우선 림프계를 거쳤던 지방의 경로와 다름에 유의하라. 간으로 이동한 아미노산은 가장 먼저 아미노기전달효소(Aminotransferase)에 의해 아미노기가 제거된다.

모든 아미노기는 최소 2개 이상의 탄소(카복실기의 탄소와 중심 탄소)를 갖는다. 중심 탄소를 α 탄소라 부르기도 하는데, 아미노기 제거 반응은 α 탄소의 아미노기를 케톤기(=O)로 치환하는 반응이다. α 탄소에 케톤기가 위치한 화합물을 α-케토산(α-Keto acid)이라 부른다.

간에서의 아미노기 전이는 α-케토글루타르산과 L-글루탐산에 의해 수행된다. α-케토글루타르산은 L-글루탐산의 케토산이다. α-케토글루타르산은 또한 시트르산 회로의 중간체였던 것을 기억하자. α-케토글루타르산은 다른 아미노산으로부터 아미노기를 받아 L-글루탐산으로 전환되고, 아미노기를 건넨 아미노산은 그 아미노산의 α-케토산으로 전환된다. 전환된 α-케토산은 각각의 구조에 따라 다른 이화 경로를 거친다.
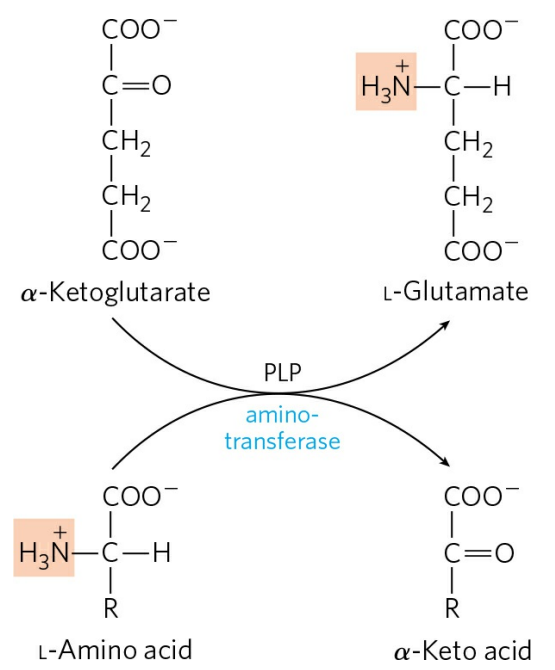
아미노기전달효소는 아미노기 주개의 이름에 따라 명명된다. 예를 들어 알라닌 아미노기전달효소는 알라닌으로부터 α-케토글루타르산으로 아미노기를 전달한다. 아미노기를 전달받아 생성된 글루탐산은 간의 미토콘드리아 내부로 이동한다. 그 후 L-글루탐산 탈수소효소(L-glutamate dehydrogenase)에 의해 산화 탈아민화(Oxidative deamination)를 거친다.
아미노기전달효소에 의해 아미노기가 α-케토글루타르산으로 전달되고, 생성된 글루탐산이 다시 미토콘드리아에서 탈아민화를 거치는 일련의 반응을 통틀어 트랜스탈아민화반응(Transdeamination)이라 한다. 대부분의 아미노산은 트랜스탈아민화반응을 거쳐 산화된다. 트랜스탈아민화반응에 의해 생성된 암모늄 이온, 혹은 암모니아는 요소 회로를 거쳐 배설된다. 이는 다음 글에서 보다 상세히 다루도록 하자.
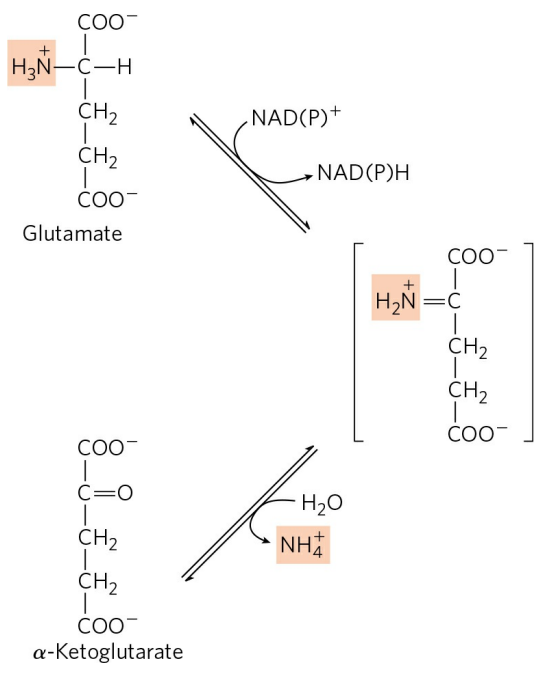
글루탐산 탈수소효소는 ADP에 의해 양성조절, GTP에 의해 음성조절된다. 이러한 조절의 대사적인 의미는 아직 밝혀지지 않았다.
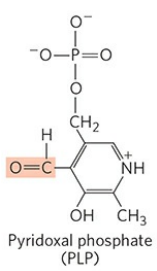
다시 아미노기전달효소로 돌아가보자. 모든 아미노기전달효소는 보결단으로 인산 피리독살(PLP)을 갖는다. 인산 피리독살은 비타민 B6의 보조효소 형태다. 글리코겐 가인산분해효소의 보결단 또한 인산 피리독살이었다. 하지만 인산 피리독살의 주요 역할은 아미노기 대사다.
위 그림에서 빨갛게 칠해진 부분은 인산 피리독살의 알데하이드기다. 앞서 아미노기전달효소에 의해 아미노기와 케톤기가 서로 치환되었던 것처럼, 알데하이드기도 아민화(Amination)될 수 있다.
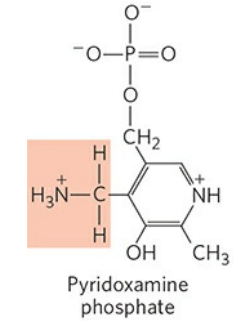
인산 피리독살과 아민화 형태인 피리독사민 인산(Pyridoxamine phosphate)은 상호 전환이 가능하다. 그래서 인산 피리독살은 아미노기전달효소에서 아미노기의 중간 운반체로 작용할 수 있다.
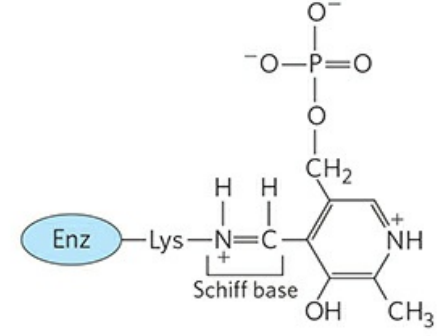
인산 피리독살의 알데하이드기는 아미노기전달효소의 라이신(Lys) 잔기에 결합한다. 이때 쉬프 염기(Schiff nases)를 형성하는데, 쉽게 말해 탄소-질소 간 이중결합을 갖는다고 생각해두자. 이를 다른 말로 알디민 결합(Aldimine linkage)이라고도 한다. 효소와 인산 피리독살이 결합한 이 형태를 효소의 내부 알디민형이라 칭한다.
효소의 내부 알디민형 인산 피리독살은 아미노산의 α 탄소에 대해 세 가지 역할을 수행할 수 있다. 각각 아미노기의 전달, 카복실기의 제거, L형과 D형의 전환이다. 세 역할 모두 인산 피리독살의 작용 원리는 동일하다.
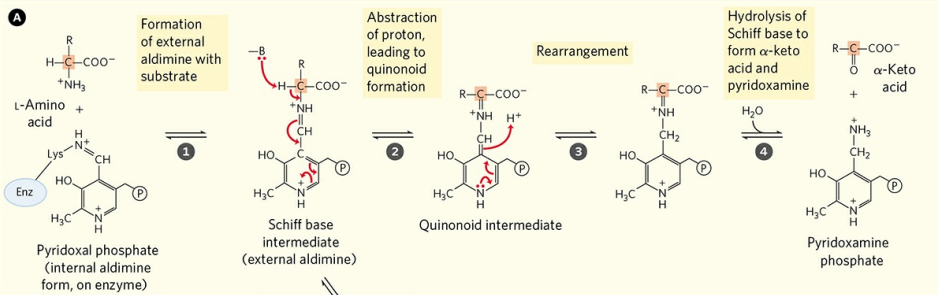
효소의 라이신 잔기와 결합한 효소 내부 알디민형 인산 피리독살이 기질 아미노산의 아미노기와 결합하면, 쉽게 말해 인산 피리독살이 아미노기를 통해 기질 아미노산을 잡아두면, 일련의 반응을 통해 아미노산은 여러 변형이 이루어진다. 위 그림에서는 케톤기 형성을 위한 탈수소 반응이 이뤄지고 있다. 이때, 탄소의 네 결합 자리 중 하나가 사라질 때 탄소 원자는 매우 불안정해지는데, 인산 피리독살이 공명 안정화(Resonance stabilization)를 통해 이를 안정화시킨다. 이후 변형된 아미노산은 유리되고, 아미노기는 인산 피리독살로 전해져 피리독사민 인산을 형성한다.
정리해보자. 소화로 유입된 아미노산은 소장의 상피 세포, 모세혈관을 거쳐 간에 도달한다. 간에서 이들은 아미노기전달효소에의해 탈아미노화된다. 아미노기전달효소는 보결단으로 인산 피리독살을 필요로 한다. 인산 피리독살은 아미노산의 아미노기를 붙잡아두어 안정성을 제공한다. 그 후 아미노기를 전달받은 글루탐산은 간의 미토콘드리아 내부로 들어가 산화 탈아민화된다. 이 과정을 통틀어 트랜스탈아민화반응이라 한다.
3. 혈류에서의 암모니아 운반
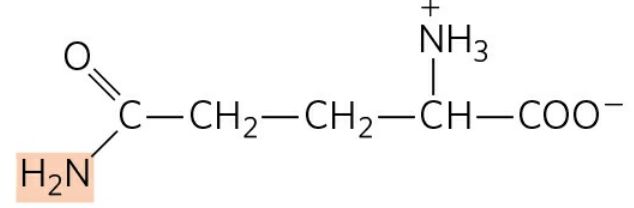
혈류의 암모니아 운반체는 글루타민(Glutamine)이다. 암모니아는 동물 조직에 매우 유독한데, 뇌를 포함한 많은 조직에서 대사 과정 중 유리 암모니아가 생성된다. 이들은 글루타민 합성효소(Glutamine synthetase)에 의해 빠르게 글루탐산과 결합하고, 이후 혈액을 따라 간과 신장으로 운반된다.
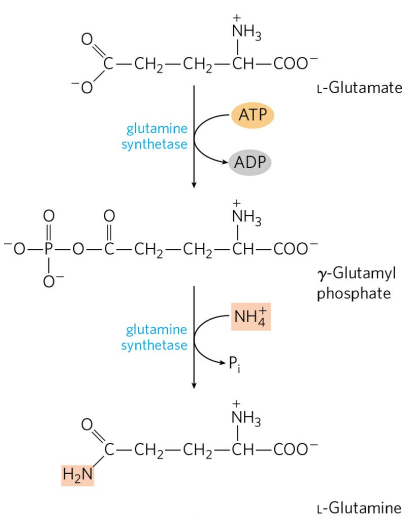
글루타민 합성에는 한 분자의 ATP를 필요로 한다. 글루타민은 암모니아, 혹은 암모늄 이온의 무독성 운송 형태이고, 다른 아미노산에 비해 훨씬 고농도로 혈중에 존재한다. 이는 글루탐산 또한 마찬가지다.
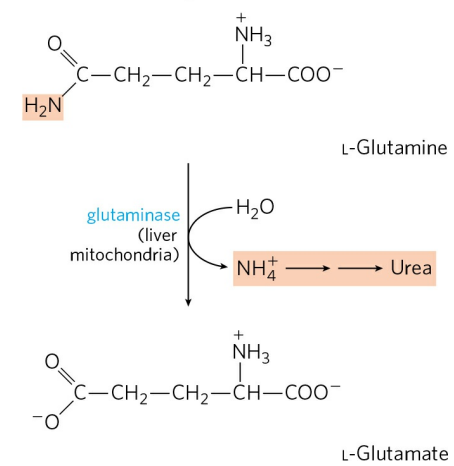
고농도의 글루타민은 다시 간의 미토콘드리아에서 글루타민분해효소(Glutaminase)에 의해 분해되어 글루탐산으로 전환된다. 유리된 암모늄 이온은 요소 회로를 거쳐 배설된다. 생성된 글루탐산이 글루탐산 탈수소효소에 의해 추가적으로 탈아민화될 수도 있지만, 일반적으로 글루탐산은 여러 생합성 반응의 아미노기 전달 반응에 이용된다.
4. 근육에서의 암모니아 운반
근육에서 생성된 아미노기 또한 간으로 운반될 필요가 있다. 이때 아미노기의 운반체로 알라닌을 추가로 이용한다. 알라닌은 피루브산의 아민화 형태이다.
근육에 다량 존재하는 피루브산은 알라닌 아미노기전달효소(Alanine aminotransferase)에 의해 알라닌으로 전환된다. 이렇게 생성된 알라닌은 혈액을 통해 간으로 이동하고, 간에서 알라닌은 다시 같은 효소에 의해 피루브산으로 전환된다.
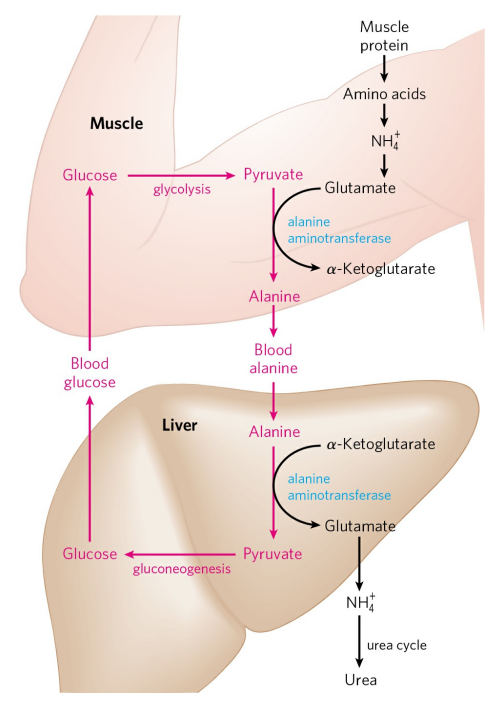
왜 근육은 알라닌을 이용하는가? 이는 이것이 매우 경제적이기 때문이다. 골격근은 무산소 상태에서 작동하므로 피루브산과 젖산을 생성한다. 피루브산과 젖산은 대사되기 위해 간으로 이동되어야 하는데, 이 과정에서 노폐물인 아미노기 또한 피루브산에 더해 간으로 보내버리는 것이다. 간으로 보내진 피루브산은 포도당신생성을 거쳐 포도당으로 합성되고, 포도당은 다시 근육으로 돌아가 근수축의 연료가 된다. 이러한 일련의 과정을 포도당-알라닌 회로(Glucose-alanine cucle)라 부른다.
여기까지 각각의 조직에서 아미노기가 어떻게 다뤄지는지에 대해 살펴봤다. 다음 글에서는 간의 미토콘드리아에서 아미노기가 어떻게 배설되는지에 대해 알아보도록 하자.
'휴지통' 카테고리의 다른 글
| [생화학] 아미노산 분해 경로 (Pathways of Amino Acid Degradation) (0) | 2022.09.01 |
|---|---|
| [생화학] 요소 회로 (Urea cycle) (0) | 2022.09.01 |
| [생화학] 케톤체 (Ketone Bodies) (0) | 2022.08.17 |
| [생화학] 지방산의 산화 (Oxidation of Fatty Acids) (3) | 2022.08.13 |
| 카보닐, 아실, 알데하이드, 케톤 (Carbonyl, Acyl, Aldehyde, Ketone) (0) | 2022.08.13 |



